题目内容
【题目】下列化合物中能量最低的是( )
A.HF
B.H2O
C.H2S
D.CH4
【答案】A
【解析】解:元素的非金属性越强,其氢化物越稳定,非金属性:F>O>S>C,则氢化物的稳定性:HF>H2O>H2S>CH4;物质具有的能量越高越不稳定,所以HF具有的能量最低, 故选A.
【考点精析】利用非金属在元素周期表中的位置及其性质递变的规律对题目进行判断即可得到答案,需要熟知在目前已知的112种元素中,非金属元素有22种,除H外非金属元素都位于周期表的右上方(H在左上方).F是非金属性最强的元素.

【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
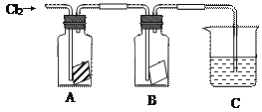
(1)通入Cl2一段时间后,A、B装置中,红色纸条的现象和结论为:
装置 | 现象 | 结论 |
A | ______________ | 潮湿的氯气______(填能或不能)使红色纸条褪色,因为反应生成的____________具有漂白性 |
B | ______________ |
(2)C装置的作用是__________________________
写出装置C中反应的化学方程式:_________________________________
【题目】工业上可用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
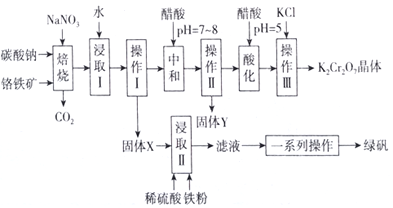
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+4CO2↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。