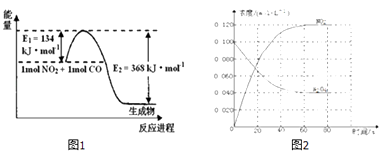
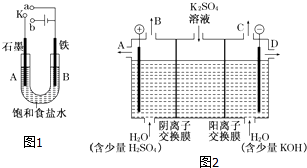
题目内容
【题目】A、B、C、D四种化合物,有的是药物,有的是香料.它们的结构简式如下所示: 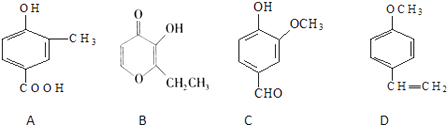
(1)化合物A的分子式是;A中含有的官能团的名称是;
(2)A、B、C、D四种化合物中互为同分异构体的是;
(3)化合物B的核磁共振氢谱中出现组峰;
(4)1molD最多能与mol的氢气发生加成反应.
【答案】
(1)C8H8O;酚羟基、羧基
(2)A、C
(3)5
(4)4
【解析】解:(1)由结构简式可知分子式为C8H8O3 , A中含﹣OH、﹣COOH,为酚羟基、羧基,故答案为:C8H8O3;酚羟基、羧基;(2)分子式相同、结构不同的有机物互为同分异构体,以上四种物质中A、C为同分异构体,故答案为:A、C;(3)化合物B结构不对称,含5种位置的H,其核磁共振氢谱中出现5组峰,故答案为:5;(4)D中苯环、C=C均可与氢气发生加成反应,则1mol D最多能与4mol的氢气发生加成反应,故答案为:4.(1)由结构简式确定分子式,A中含﹣OH、﹣COOH;(2)分子式相同、结构不同的有机物互为同分异构体;(3)化合物B结构不对称,含5种位置的H;(4)D中苯环、C=C均可与氢气发生加成反应.

练习册系列答案
相关题目