题目内容
【题目】氮及其化合物在生产、生活中有着重要的作用.请回答下列问题: 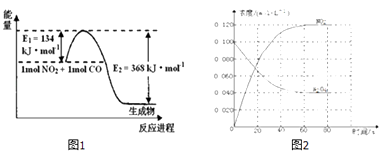
(1)图1是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)2NO2(g)△H如图2
①在0﹣60s时段,反应速率v(N2O4)为molL﹣1s﹣1 .
②温度升高,混合气体的颜色变深,则△H0(填“>”或“<”).
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有(填字母).
a.向混合气体中通入N2O4 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2 , 反应2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液.
①A、B两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为(已知HNO2的电离
常数Ka=7.1×10﹣4molL﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).
②可使A、B两溶液的PH相等的方法是(填字母).
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平).0.6molCu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为 .
【答案】
(1)NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol
(2)0.001;>;ac
(3)c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);bc
(4)1.8mol
【解析】解:(1)该反应的焓变△H=E1﹣E2=134kJ/mol﹣368kJ/mol=﹣234kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol,所以答案是:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol;(2)①由图可知,在0﹣60s时段△c(N2O4)=0.1mol/L﹣0.04mol/L=0.06mol/L,则v(N2O4)= ![]() =0.001mol/(L.min),
=0.001mol/(L.min),
所以答案是:0.001;
②温度升高,混合气体的颜色变深,说明升高温度平衡向生成NO2的方向移动,升高温度平衡向吸热反应移动,则△H>0,
所以答案是:>;
③a.向混合气体中通入N2O4 , 等效为在原平衡基础上增大压强到达的平衡,平衡逆向移动,N2O4的体积分数增大,故a正确;
b.正反应为吸热反应,升高温度平衡向正反应方向移动,N2O4的体积分数减小,故b错误;
c.向混合气体中通入NO2 , 等效为在原平衡基础上增大压强到达的平衡,N2O4的体积分数增大,故c正确;
d.使用高效催化剂缩短到达平衡的水解,不影响平衡移动,N2O4的体积分数不变,故d错误,
所以答案是:ac;(3)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1molL﹣1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10﹣4molL﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1 , 说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣),
a.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故a错误;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故b正确;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故c正确;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故d错误;
所以答案是:c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);bc;(4)参加反应的硝酸转化为Cu(NO3)2、NO、NO2 , 根据Cu原子守恒可知n[Cu(NO3)2]=n(Cu)=0.6mol,得到的NO和NO2物质的量相同,根据电子转移守恒,则:3n(NO)+n(NO2)=0.6mol×2,故n(NO)=n(NO2)=0.3mol,根据氮原子守恒,可知n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.6mol×2+0.3mol+0.3mol=1.8mol,
所以答案是:1.8mol.
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.