题目内容
16.某有机物A只含有C、H、O三种元素,常用作有机合成的中间体.现将8.4g该有机物在14.56L(标况下)O2经充分燃烧后将产生的热气体(无有机物)先通过足量的无水CaCl2固体,发现该固体增重7.2g,然后再将该剩余气体通入足量的澄清石灰水,石灰水增重22.0g;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1.(注:-OH接在不饱和碳上为不稳定结构)(1)通过计算确定该有机物A的分子式为C5H8O,A的结构简式为
 .
.(2)有机物B是A的同分异构体,1mol B可与1mol Br2加成.该有机物所有碳原子在同一个平面,没有顺反异构现象.请写出B的结构简式是(CH3)2C=CHCHO.
分析 (1)有机物A只含有C、H、O三种元素,其相对分子质量为84,8.4g有机物A的物质的量为:$\frac{8.4g}{84g/mol}$=0.1mol,充分燃烧后将产生的热气体(无有机物)先通过足量的无水CaCl2固体,发现该固体增重7.2g,故燃烧生成水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,再将该剩余气体通入足量的澄清石灰水,石灰水增重22.0g,故 CO2的物质的量为:$\frac{22.0g}{44g/mol}$=0.5mol,故有机物A中C原子数目为:5,H原子数目为8,根据相对分子量计算出含有氧原子的数目,然后写出A的分子式;该有机物的不饱和度为:$\frac{5×2+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个-OH连接在同一C原子上,据此写出有机物A的结构简式;
(2)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式书写.
解答 解:(1)有机物A只含有C、H、O三种元素,其相对分子质量为84,8.4g有机物A的物质的量为:$\frac{8.4g}{84g/mol}$=0.1mol,充分燃烧后将产生的热气体(无有机物)先通过足量的无水CaCl2固体,发现该固体增重7.2g,故燃烧生成水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,再将该剩余气体通入足量的澄清石灰水,石灰水增重22.0g,故 CO2的物质的量为:$\frac{22.0g}{44g/mol}$=0.5mol,故有机物A中C原子数目为:5,H原子数目为8,根据相对分子量计算出含有氧原子的质量为:84-5×12-8=16,即数目为:$\frac{16}{16}$=1,故此有机物的分子式为:C5H8O,该有机物的不饱和度为:$\frac{5×2+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,则该有机物分子中含有2个CH3、1个-OH连接在同一C原子上,所以A的结构简式为: ,故答案为:C5H8O;
,故答案为:C5H8O; ;
;
(2)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式可知,B中还含有-CHO,故B为(CH3)2C=CHCHO,
故答案为:(CH3)2C=CHCHO.
点评 本题考查有机物分子式、结构简式的计算,题目难度中等,明确有机物结构与性质为解答本题的据此,注意掌握确定常见有机物分子式、结构简式的方法,试题有利于培养学生的分析、理解能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
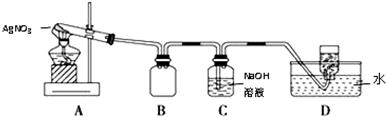
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 乙炔 |
| A. | 假若为平面四边形,则有三种同分异构体 | |
| B. | 假若为四面体,则有两种同分异构体 | |
| C. | 假若为平面四边形,则无同分异构体 | |
| D. | 假若为四面体,则无同分异构体 |
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
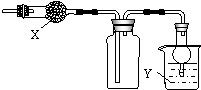 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: