题目内容
18.A、B、C、D为短周期元素,在元素周期表中的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数.下列叙述不正确的是( )| A | C | |
| B | D |
| A. | 气态氢化物的稳定性:HC>HD | |
| B. | 最高价氧化物对应水化物的酸性:H2BO4>HDO4 | |
| C. | 单质沸点最高的是B元素形成的单质 | |
| D. | A简单气态氢化物水溶液显碱性 |
分析 A、C两元素的原子核外电子数之和等于B元素原子的质子数,设B的质数为x,A、C的核外电子数分别为x-9、x-7即x-9+x-7=x,则x=16,所以B为硫元素,A、C分别是氮元素和氟元素,结合A、B、C、D为短周期元素,在周期表中所处的位置可知:D为氟元素,根据此回答上述问题.
解答 解:A、非金属性越强,氢化物越稳定,非金属性:氟>氟,所以稳定性:HF>HCl,故A正确;
B、非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性:S<Cl,所以硫酸的酸性弱于高氯酸,故B错误;
C、硫常温下是固体,沸点比气体的沸点高,故C正确;
D、A的气态氢化物是氨气,水溶液呈碱性,故D正确;
故选B.
点评 本题考查位置结构性质关系的综合应用,题目难度不大,注意根据质子数关系结合元素所在周期表中的位置推断元素的种类.

练习册系列答案
相关题目
3.下列对有机物C6H12O2结构的猜测不正确的是( )
| A. | 分子中可能含有一个醛基、一个羟基 | |
| B. | 分子中可能含有一个碳碳双键、两个羟基 | |
| C. | 六个碳原子可能连成环状 | |
| D. | 分子中可能含有一个羧基、一个碳碳双键 |
6.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2-3.8(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4,.

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
13.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2 粗品.
②有关物质的部分性质如上表:
设计实验装置图如下:
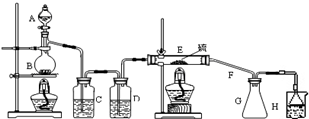
请回答下列问题:
(1)B 中反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E 中反应的化学方程式2S+C12$\frac{\underline{\;\;△\;\;}}{\;}$S2C12.
(2)C、D 中的试剂分别是饱和食盐水、浓硫酸.
(3)如果在加热E时温度过高,对实验结果的影响是S2Cl2因温度过高会分解.
(4)根据S2Cl2的性质,在述实验装置中G、H之间应添加干燥装置.
| 物质 | 熔点/℃ | 沸点 | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S,300℃以上完全分解,S2Cl2+Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2 |
②有关物质的部分性质如上表:
设计实验装置图如下:

请回答下列问题:
(1)B 中反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E 中反应的化学方程式2S+C12$\frac{\underline{\;\;△\;\;}}{\;}$S2C12.
(2)C、D 中的试剂分别是饱和食盐水、浓硫酸.
(3)如果在加热E时温度过高,对实验结果的影响是S2Cl2因温度过高会分解.
(4)根据S2Cl2的性质,在述实验装置中G、H之间应添加干燥装置.
3.下列物质属于天然高分子的是( )
| A. | 蛋白质 | B. | 天然气 | C. | 聚乙烯 | D. | 葡萄糖 |
10.下列物质中能发生消去反应的是( )
| A. | (CH3)3CCH2Br | B. | CH3Br | C. | 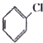 | D. |  |
7.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图,下列有关氢氧燃料电池的说法不正确的是( )
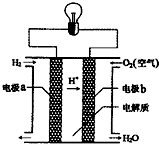

| A. | a电极是负极 | |
| B. | 该电池的总反应:2H2+O2═2H2O | |
| C. | 产物为无污染的水,属于环境友好电池 | |
| D. | 外电路中电子b电极通过导线流向a电极 |