题目内容
20.设NA为阿伏伽德罗常数的值.下列说法正确的是(相对原子量:N-14 H-1)( )| A. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| B. | 标准状况下,2.24L H2O中含有H2O分子数为0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 实验室所制得的1.7g NH3中含有的电子数为NA |
分析 A、消耗4mol氯化氢气体,可以生成1mol氯气;但是浓盐酸变成稀盐酸后反应停止,生成的氯气的物质的量小于1mol;
B、标准状况下,水是液体;
C、1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.2NA;
D、NH3分子中含有10g电子,1.7g NH3含有的电子数为NA.
解答 解:A、二氧化锰与浓盐酸反应生成氯气,消耗4mol氯化氢能够生成1mol氯气;由于随着反应的进行,浓盐酸变成稀盐酸后反应停止,所以含4molHCl的浓盐酸与足量的MnO2反应生成的氯气的物质的量小于1mol,生成的标况下氯气的体积小于22.4L,故A错误;
B、标准状况下,水是液体,不能用气体摩尔体积公式计算,故B错误;
C、NaHSO4在水溶液中完全电离,1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.2NA,故C错误;
D、NH3分子中含有10g电子,1.7g NH3的物质的量为0.1mol,含有的电子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意稀盐酸与二氧化锰不反应;阿伏加德罗常数是高考的“热点”.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列叙述正确的是( )
| A. | 1molO2的质量为32g/mol | |
| B. | 1mol物质的质量等于该物质的相对分子质量 | |
| C. | SO42-的摩尔质量为96g/mol | |
| D. | 1mol CO2的体积是22.4L |
2.有关物质的性质及其用途的描述,正确的是( )
①Al2O3(是氧化物,因熔点很高作耐火坩埚)
②KAl(SO4)2•12H2O(因氧化性作水的消毒剂)
③Fe2O3(因其颜色且性质稳定作黑色油漆或涂料)
④Na2CO3(属于盐类,因其溶液显碱性作食用碱)
⑤钠、钾、锶、钡等化合物(因焰色反应作烟花)
⑥Na2O2(不属于碱性氧化物,因可吸收水分及CO2时放出氧气作呼吸面具供氧剂)
①Al2O3(是氧化物,因熔点很高作耐火坩埚)
②KAl(SO4)2•12H2O(因氧化性作水的消毒剂)
③Fe2O3(因其颜色且性质稳定作黑色油漆或涂料)
④Na2CO3(属于盐类,因其溶液显碱性作食用碱)
⑤钠、钾、锶、钡等化合物(因焰色反应作烟花)
⑥Na2O2(不属于碱性氧化物,因可吸收水分及CO2时放出氧气作呼吸面具供氧剂)
| A. | ①④⑤⑥ | B. | ①②⑤⑥ | C. | ①③④⑤ | D. | 全部 |
15.糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色.如何识别这些物质的真伪,既可以检验同学们将化学知识与实际相结合的能力水平,又可以减少伪劣物品对我们生活质量的负面影响.请根据下列的实验现象填写下表:
①烧焦羽毛味;②蓝色;③银镜(析出银);④砖红色沉淀;⑤黄色
①烧焦羽毛味;②蓝色;③银镜(析出银);④砖红色沉淀;⑤黄色
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可) |
| 葡萄糖 | 新制氢氧化铜 | |
| 淀粉 | 碘水 | |
| 蛋白质 | 硝酸 | |
| 蛋白质 | 燃烧 | |
| 葡萄糖 | 银氨溶液 |
12.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )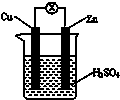

| A. | Zn是负极,发生还原反应 | |
| B. | 一段时间后,铜片质量减轻 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 一段时间后,电解质溶液的酸性保持不变 |
9.下列说法中,正确的是( )
| A. | 1-丁烯和2-丁烯都存在顺反异构现象 | |
| B. | 一氯甲烷不存在同分异构体的事实可以证明甲烷分子是正四面体形分子 | |
| C. | 间二氯苯只有一种结构的事实可以证明苯分子是正六边形分子 | |
| D. | 苯不能使高锰酸钾酸性溶液或溴的四氯化碳溶液褪色可以证明苯分子中的碳碳键完全相同 |
10.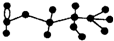 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | ①④⑤ |
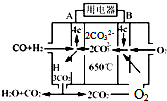 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.