��Ŀ����
��10�֣�
��1���Ʊ�������������Ļ�ѧ����ʽΪ ��
��2��̼��������ˮ��Һ�еĵ��뷽��ʽΪ ��
��3����֤��Na2SO3��Һ�д���SO32��+H2O HSO3��+OH��ˮ��ƽ�����ʵ�� ����ѡ����ĸ����
HSO3��+OH��ˮ��ƽ�����ʵ�� ����ѡ����ĸ����
A�������̪��Һ��죬�ټ���H2SO4��Һ���ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ
��4�����п��淴Ӧ��2A(g)��2B(g) C(g)��3D(s)�����ܱ��������ݻ����¶ȶ���ͬ�������£��ֱ����������;������ƽ�⣺��. A��B����ʼ���ʵ�����Ϊ2 mol����.C��D����ʼ���ʵ����ֱ�Ϊ2 mol��6 mol������˵������ȷ���� ����ѡ����ĸ����
C(g)��3D(s)�����ܱ��������ݻ����¶ȶ���ͬ�������£��ֱ����������;������ƽ�⣺��. A��B����ʼ���ʵ�����Ϊ2 mol����.C��D����ʼ���ʵ����ֱ�Ϊ2 mol��6 mol������˵������ȷ���� ����ѡ����ĸ����
A��������;�����մﵽƽ��ʱ����ϵ�ڻ������İٷ������ͬ
B���ﵽƽ��ʱ��;�������û�����ܶ�Ϊ;�������û�����ܶȵ�2��
C���ﵽƽ��ʱ��;����C��ƽ��Ũ�ȴ���;����C��ƽ��Ũ�ȵ�2��
��5���ں��ݾ��ȣ�������罻�������������½���2A (g)+ B(g) 2C(g)+ D(s)��Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߡ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ�� ��
2C(g)+ D(s)��Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߡ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ�� ��
| ���� | A | B | C | D |
| ��ʼͶ��/mol | 2 | 1 | 2 | 0 |
��1�� FeCl3 + 3H2O  Fe(OH)3 (����)+ 3HCl ��2�֣�
Fe(OH)3 (����)+ 3HCl ��2�֣�
��2�� NaHCO3 = Na+ + HCO3 - ��2�֣�
��3��C ��2�֣�
��4�� C ��2�֣�
��5��K���¶ȵ����߶���С��2�֣�
���������������1���Ȼ����ڷ�ˮ��ˮ���Ʊ����壬�Ʊ���ӦΪFeCl3+3H2O Fe��OH��3�����壩+3HCl��
Fe��OH��3�����壩+3HCl��
��2��̼������Ϊǿ����ʣ���ˮ��Һ�еĵ��뷽��ʽΪNaHCO3=Na++HCO3-��
��3��A�������̪��Һ��죬�ټ���H2SO4��Һ��Ӧ���������ơ�ˮ�Ͷ���������ȷ��ˮ��ƽ��Ĵ��ڣ�����B�������̪��Һ��죬�ټ�����ˮ����������ԭ��Ӧ�����������ƣ�����ˮ��HClO����Ư���ԣ�����ȷ��ˮ��ƽ��Ĵ��ڣ�����C�������̪��Һ��죬�ټ���BaCl2��Һ��SO32-+H2O?HSO3-+OH-ˮ��ƽ�������ƶ������������Һ�ɫ��ȥ����ȷ��
��4�����ܱ��������ݻ����¶ȶ���ͬ�������£��ֱ����������;������ƽ�⣺��A��B����ʼ���ʵ�����Ϊ2mol����C��D����ʼ���ʵ����ֱ�Ϊ2mol��6mol������;��II����ת��ΪA��B��A��B����ʼ���ʵ�����Ϊ4mol������Ϊ��Чƽ�⣬��DΪ���壬II��ѹǿ��ƽ�������ƶ�����A��������;�����մﵽ��ƽ��Ϊ��Чƽ�⣬II��ѹǿ��ƽ�������ƶ������ƴ�����ϵ�ڸ��������İٷ���ɲ���ͬ������B���ﵽƽ��ʱ��DΪ���壬���������������С�ڢ��2�����������ݻ���ͬ����;�������û�����ܶ�С��;�������û�����ܶȵ�2��������C���ﵽƽ��ʱ������ƽ��Ϊ��Чƽ�⣬���ڢ��г�ʼ��Ӧ��Ϊ���2����II��ѹǿ������C����I�ж��2�����������ݻ���ͬ���ﵽƽ��ʱ��;����C��ƽ��Ũ�ȴ���;����C��ƽ��Ũ�ȵ�2������ȷ��
��5������ʼD�����ʵ���Ϊ0��֪����Ӧ2A ��g��+B��g��?2C��g��+D��s��������Ӧ���н���ƽ�⣬����Ӧ�����������С�ķ�Ӧ��������������䣬ƽ��ʱѹǿ���ʾ��������£����������¶����ߣ�������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У���ѧƽ�ⳣ����С��
���㣺���⿼�黯ѧƽ����жϺ��ƶ�������ʽ����д����Чƽ�⡢��ѧƽ�ⳣ����

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д����з�Ӧ��ϵ�У������ڿ��淴Ӧ����
| A��Cl2�ܽ���ˮ |
| B�������ܽ���ˮ |
| C����ҵ�ϳɰ� |
| D��ˮ�������H2��O2��H2��O2��ȼ������H2O |
��ͬ��ͬѹ�����£���֪�� C��CO2 2CO������Ӧ�����ȣ�������Ӧ�ķ�Ӧ����Ϊv1��N2��3H2
2CO������Ӧ�����ȣ�������Ӧ�ķ�Ӧ����Ϊv1��N2��3H2 2NH3������Ӧ�Ƿ��ȣ�������Ӧ�ķ�Ӧ����Ϊv2������������Ӧ�����¶�ͬʱ����ʱ��v1��v2�ı仯�����ȷ����
2NH3������Ӧ�Ƿ��ȣ�������Ӧ�ķ�Ӧ����Ϊv2������������Ӧ�����¶�ͬʱ����ʱ��v1��v2�ı仯�����ȷ����
| A��ͬʱ���� | B��ͬʱ��С |
| C��v1����v2��С | D��v1��С��v2���� |
����Ϊ�����䶳ѧ֮�������ء���͢��Robert Ettinger����1962��д���������ǰ������The Prospect Of Immortality��һ�顣���������о��˴�����ʵ��֤�����䶳����Ŀ��ܡ����磬��������͵͵����ﶬ�춼�����������������Զ�������н�������������Ϣ��ص���
| A���¶�Խ�ͣ���ѧ��ӦԽ�� | B�������·������˶� |
| C���¶Ƚ��ͣ���ѧ��Ӧֹͣ | D����ѧ��Ӧǰ�������غ� |
���á���ѧ����ת�Ʒ����Ʊ�TaS2���壬ij�¶��µ�2L�����ܱ������м���һ���� �� I2��g����TaS2��s���������·�Ӧ
TaS2��s��+2I2��g�� TaI4��g��+S2��g����H��a kJ��mol-1 ��I��
TaI4��g��+S2��g����H��a kJ��mol-1 ��I��
��ƽ��ʱ��TaS2��s����I2��g����TaI4��g������S2��g�������ʵ����ֱ�Ϊ3 mol ��2mol��2mol��2mol��
��1����Ӧ��I����ƽ�ⳣ������ʽK=
��2�������¶��¸�������ijʱ��TaS2��s����I2��g����TaI4��g������S2��g�������ʵ����ֱ�Ϊ2mol��2mol��4mol��4mol�����ʱ��ƽ���� �������Ӧ�����淴Ӧ�����ƶ���v�� v�棨���������������������
��3���ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ��K���±���
| �¶�/�� | 40 | 80 | 200 |
| ƽ�ⳣ��K | 1 | 1.5 | 4 |
��4��40��ʱ����ú����ܱ������м���2mol I2��g����4mol TaS2��s����I2��g����ƽ��ת����Ϊ (д��������̣��������С�����1λ)
��12 �֣�T��ʱ����ij�ݻ���Ϊ2L�ܱ������г���2molN2��4molH2���ڴ��������·�����Ӧ��N2(g)+3H2(g) 2NH3(g) ��H=��92.0kJ /mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯�����������ͼ��ʾ��
2NH3(g) ��H=��92.0kJ /mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯�����������ͼ��ʾ��
�Իش��������⣺
��1��T��ʱ��N2��ת����Ϊ��___________���÷�Ӧ��ƽ�ⳣ��K=___________��
��2��T��ʱ��������֤���÷�Ӧ�Ѿ�����ƽ��״̬���ǣ�__________________��
| A����ϵ��ѹǿ���ٸı� |
| B�����������ɫ���ٸı� |
| C��H2�������ٷֺ������ٸı� |
| D��c(N2)��c(NH3)�ı�ֵ���ٸı� |
��4��T��ʱ������ƽ����������м���2molN2��2molNH3�����ʱ v�� ___ v����
����β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£� N2(g)��O2(g)? 2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
��1��ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________��
| A������1 mol N2ͬʱ����1 mol O2 | B����������ܶȲ��� |
| C���������ƽ����Է����������� | D��2v(N2)����v(NO)�� |
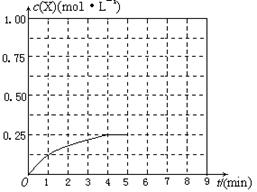
��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������______��(������С�����䡱)
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1mol/L��4.0��10��2mol/L��3.0��10��3mol/L����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������____
(14��)����������Ԫ��A��B��C��D��Eԭ�������������� �� A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B���γɻ�������������Ԫ�أ�Cԭ�ӵ������������Ǵ�����������3����D��ͬ�����н�������ǿ��Ԫ�أ�E�ĸ�һ��������C��ij���⻯����Ӻ�����ͬ�ĵ�������
��A��C��D�γɵĻ������к��еĻ�ѧ������Ϊ ��
����֪��
�� E��E��2E�� ?H����a kJ/mol��
�� 2A��A��A�� ?H����b kJ/mol��
�� E��A��A��E��?H����c kJ/mol��
д��298Kʱ��A2��E2��Ӧ���Ȼ�ѧ����ʽ ��
����ij�¶����ݻ���Ϊ2 L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2A2(g)��BC(g) X(g)�� ?H����Q kJ/mol(Q��0��XΪA��B��C����Ԫ����ɵ�һ�ֻ�����)����ʼͶ����������ﵽƽ��ʱ���й��������£�
X(g)�� ?H����Q kJ/mol(Q��0��XΪA��B��C����Ԫ����ɵ�һ�ֻ�����)����ʼͶ����������ﵽƽ��ʱ���й��������£�
| ʵ�� | �� | �� | �� |
| ��ʼͶ�� | 2 mol A2��1 mol BC | 1 mol X | 4 mol A2��2 mol BC |
| ƽ��ʱn(X) | 0.5 mol | n2 | n3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ��ϵ��ѹǿ | P1 | P2 | P3 |
| ��Ӧ���ת���� |  1 1 |  2 2 |  3 3 |
v (A2)= ��
�� ������¶��´˷�Ӧ��ƽ�ⳣ��K = ��
�����������еķ�Ӧ�ֱ��ƽ��ʱ���и������ݹ�ϵ��ȷ���� (����ĸ)��
A����1����2��1 B��Q1��Q2��Q C����3����1
D��P3��2P1��2P2 E��n2��n3��1.0 mol F��Q3��2Q1
���������������������£��������������ѹ����1 L�����ڵ�8min�ﵽ�µ�ƽ��ʱA2����ת����Ϊ75%��������ͼ�л�����5min ����ƽ��ʱX�����ʵ���Ũ�ȵı仯���ߡ�
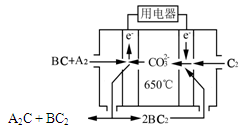
������̼����ȼ�ϵ��(MCFC)��һ�ָ���ȼ�ϵ�أ�����Ϊ�ڶ���ȼ�ϵ�أ���δ�����÷��������ѡ��֮һ���乤��ԭ����ͼ��ʾ������A2(g)��BC(g)Ϊȼ�ϣ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʡ�д����̼����ȼ�ϵ��(MCFC)�����ĵ缫��Ӧʽ____________________________��
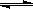 C��g��+D��g�����������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
C��g��+D��g�����������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺