题目内容
(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
| A.体系总压强不再改变 |
| B.混合气体颜色不再改变 |
| C.H2的质量百分含量不再改变 |
| D.c(N2)与c(NH3)的比值不再改变 |
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
(12 分,每空2分)
(1) 50 %; 16(mol?L?1)-2 (2) ACD (3) 升温 ;= (4) >
解析试题分析:(1)根据N2(g)+3H2(g) 2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
(2)A、该反应前后气体的系数不相等,所以体系总压强不再改变,反应达到平衡;B、反应体系中各气体均为无色,所以混合气体颜色不再改变不能说明建立平衡;C、H2的质量百分含量不再改变,说明反应已达到平衡;D、c(N2)与c(NH3)的比值不再改变,说明c(N2)与c(NH3)不变,反应已达到平衡。
(3)t1时刻,正、逆反应速率都增大,逆反应速率更大,平衡向逆反应方向移动,该反应为放热反应,所以改变的条件是升温;t6正反应速率在原来的基础上逐渐增大,则改变的条件不是温度,所以平衡常数不变,所以K(t5~t6) = K(t7~t8)。
(4)向容器中加入2molN2和2molNH3,c(N2)=(1mol+2mol)÷2L=1.5mol?L?1,c(NH3)=(2mol+2mol)÷2L=2mol?L?1,则浓度积=(2mol?L?1)2÷[1.5mol?L?1×(0.5mol?L?1)3]=21.3(mol?L?1)-2 > K,平衡向正反应方向移动,所以v正 > v逆。
考点:本题考查转化率的计算、化学平衡常数的计算及计算、化学平衡状态的判断、化学平衡移动。

对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使放出H2速率加快的是
①升高温度
②改用100mL 1mol/L硫酸
③多用300mL 1mol/L盐酸;
④用等量锌粉代替锌粒
⑤改用100mL 6mol/L硝酸
⑥滴入几滴硫酸铜溶液
⑦用粗锌代替纯锌使用
| A.①③④⑤⑦ | B.①②④⑥⑦ | C.②③④⑤⑥ | D.①②③⑥⑦ |
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
(10分)800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
 (3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )  HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。 C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。 CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。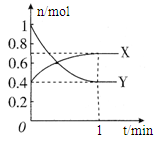
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。