题目内容
已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,溶液中c(H+) c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为 ,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为 。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH) c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-) c(H+)(填“>”,“=”或“<”)。
(1)若溶液中只溶解了一种溶质,则该溶质是 ,溶液中c(H+) c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为 ,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为 。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH) c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-) c(H+)(填“>”,“=”或“<”)。
(1)CH3COONa ; < ; (2)NaOH和CH3COONa; CH3COOH和CH3COONa, (3)< >
试题分析:(1)若溶液中只溶解了一种溶质,则该溶质是CH3COONa.由于CH3COONa是强碱弱酸盐。弱酸根离子水解CH3COO-+H2O
 CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。
CH3COOH+OH-,消耗了水电离产生的H+,破坏了水的电离平衡,水会继续电离产生的H+又被消耗,最终当达到电离平衡时,c(H+)<c(OH-)。(2)若溶液中只存在溶质CH3COONa,则由于CH3COO-水解消耗,所以 c(Na+)> c(CH3COO-);Na+、CH3COO-都是盐电离产生的,而OH-、H+都是弱电解质水电离产生的。盐的电离远大于水的电离。则c(CH3COO-)>c(OH-)。这与题意不符。说明溶液中还存在其它的电解质。由于c(OH-)>c(CH3COO-),说明还存在碱NaOH。因此该溶液中的溶质为NaOH和CH3COONa。若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则说明溶液显酸性,含有溶质CH3COOH。由于溶液中c(CH3COO-)>c(Na+),则还有溶质CH3COONa。因此该溶液中的溶质为CH3COOH和CH3COONa。(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,若二者的物质的量相等,则溶液显碱性。性质溶液恰好呈中性,则说明混合前n(CH3COOH)>n(NaOH).由于NaOH是强碱,完全电离,而CH3COOH是弱酸,部分电离,混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)>c(H+)。
练习册系列答案
相关题目
 Y2-+H3O+
Y2-+H3O+ 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。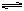 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )