题目内容
FeCl3的水解方程式可写为FeCl3+3H2O 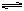 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
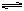 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )| A.降低温度 | B.加入少量Na2CO3 | C.加入少量盐酸 | D.增加FeCl3的浓度 |
B
试题分析:盐的水解反应是酸碱中和反应的逆反应。由于酸碱中和反应为放热反应,所以盐的水解反应是吸热反应。A.降低温度根据平衡移动原理,平衡会向放热反应方向即向逆反应方向移动,盐的水解程度减小。错误。B.加入少量Na2CO3。由于Na2CO3是强碱弱酸盐,水解使溶液显碱性,此时该盐水解产生的OH-会消耗FeCl3的水解产生的H+,由于减小了生成物的浓度,平衡正向移动,FeCl3的水解程度增大。正确。C.加入少量盐酸,c(H+)增大,由于生成物的浓度增大,平衡逆向移动,FeCl3水解程度减小。错误。D.增加FeCl3的浓度,增大了反应物的浓度,平衡正向移动,但由于平衡移动的趋势是很微弱的,投入量原大于平衡移动消耗量,所以FeCl3的水解程度反而减小。错误。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 )>c(
)>c( )>c(OH-)
)>c(OH-) 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( ) Al2O3
Al2O3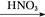 Al(NO3)3
Al(NO3)3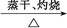 Al2O3
Al2O3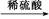 CuSO4溶液
CuSO4溶液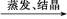 CuSO4·5H2O
CuSO4·5H2O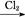 FeCl3
FeCl3 Fe(OH)3
Fe(OH)3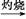 Fe2O3
Fe2O3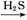 FeS
FeS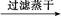 FeS
FeS HC+OH-。下列说法正确的是( )
HC+OH-。下列说法正确的是( )