题目内容
下列溶液中微粒的物质的量浓度关系正确的是
| A.25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合: c(CH3COO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液:2c(CO32-)+2c(HCO-)+2c(H2CO3)=c(Na+) |
D
试题分析:A、中性溶液中有c(H+)=c(OH-),又符合电荷守恒,c(H+)+ c(NH4+)= c(OH-)+ c(Cl-),所以有c(NH4+)=c(Cl-)> c(H+)=c(OH-),错误;B、0.1mol/LNa2S溶液中,根据质子守恒得c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C、25℃时,pH=2的CH3COOH与pH=12的NaOH溶液中,c(CH3COOH)>c(NaOH),等体积混合后的溶液实为CH3COOH和CH3COONa所以c(CH3COO-)+c(H+)>c(Na+)+c(OH-),错误;D、根据元素守恒得2c(CO32- )+2c(HCO- )+2c(H2CO3)=(Na+),正确,答案选D。

练习册系列答案
相关题目

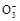
 H++C
H++C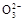
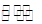 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是