题目内容
5.依据事实,写出下列反应的热化学方程式.(1)1mol N2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
(2)1mol N2(g)与适量O2(g)起反应生成NO2(g),吸收68kJ热量2N2(g)+O2(g)=2NO2(g)△H=+136KJ/mol
(3)1mol Cu(s)与适量O2(g)起反应生成CuO(s),放出157kJ热量Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ/mol
(4)1mol C(s)与适量H2O(g)起反应生成CO(g)和H2(g),吸收131.5kJ热量C(S)+H2O (g)?CO (g)+H2 (g)△H=+131.5kJ/mol
(5)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l)放出622kJ热量.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol
(6)汽油的重要成分是辛烷(C8H18),1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量.C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol.
分析 根据热化学方程式的书写原则写出热化学方程式,方程中的热量和化学计量数要对应,标注物质聚集状态和对应反应焓变.
解答 解:(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
(2)1molN2(g)与适量O2(g)起反应生成NO2(g),吸收68kJ热量,反应的热化学方程式为:2N2(g)+O2(g)=2NO2(g)△H=+136KJ/mol;
故答案为:2N2(g)+O2(g)=2NO2(g)△H=+136KJ/mol;
(3)1mol Cu(s)能与$\frac{1}{2}$molO2(g)放出反应放出157kJ热量,则其热化学方程式为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ/mol,
故答案为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ/mol;
(4)1molC与1mol水蒸气反应生成1mol CO和1mol H2,吸收131.5kJ的热量,则热化学方程式为:C (S)+H2O (g)?CO (g)+H2 (g)△H=+131.5kJ•mol-1,故答案为:C(S)+H2O (g)?CO (g)+H2 (g)△H=+131.5kJ/mol;
(5)1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量放热时焓变值为负值,所以该反应的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol;
(6)1molC8H18(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量,该反应的热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol;
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol.
点评 本题考查了热化学方程式书写方法和注意问题,注意标注物质聚集状态和对应反应焓变的计算,掌握基础是关键,题目较简单.

| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯是发生取代反应 | |
| C. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| D. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 |
| A. | 化石能源 | B. | 太阳能 | C. | 氢能 | D. | 地热能 |
(1)已知25℃时:N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol
4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol
(2)在恒温密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
②按投料Ⅱ进行反应,起始时反应进行的方向为逆向(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数变小(填“变大”、“变小”或“不变”).
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
i、X代表的物理量是温度.
ii、判断L1、L2的大小关系,并简述理:L1<L2,其他条件不变时,增大压强,衡正向移动,氢气转化率大.
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图2如下:
①电极b上发生的是还原反应(填“氧化”或“还原”).
②写出电极a的电极反应式:2NH3-6e-+6OH-=N2+6H2O.


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②振荡后静止 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③旋开活塞 | 观察到红色喷泉 | NH3极易溶于水,氨水显碱性 |
| D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| B. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| C. | 聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 | |
| D. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 |
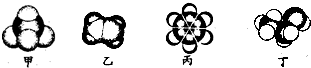
| A. | 甲中含有少量的乙可以用酸性高锰酸钾溶液除去 | |
| B. | 乙可与溴水发生取代反应使溴水褪色 | |
| C. | 丙是最简单的芳香烃,芳香烃的通式为CnH2n-6(n≥6) | |
| D. | 丁与乙酸的最简单同系物相对分子质量相同 |
| A. | Na+ K+ SO42- CO32- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl-NO3- | D. | Fe3+ K+ SO42- Cl- |