题目内容
15.在某一容积为2L的密闭容器中,X,Y,Z三种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示.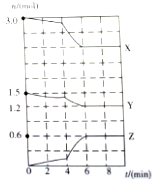
①该反应的化学方程式为2X+Y?2Z;
②0~6min内用X的浓度变化表示的平均反应速度为0.05mol•L-1•min-1;
③第4min时,曲线发生改变的条件可能是升高温度或加入催化剂.
分析 ①方程式的系数之比等于各物质的物质的量的变化量之比;
②用X的浓度变化表示的平均反应速度v=$\frac{△c}{△t}$来计算;
③根据影响化学平衡移动的因素:温度、浓度、压强、催化剂来回答.
解答 解:①反应中,X、Y的量减少,Z的量增加,所以X、Y是反应物,Z是产物,方程式的系数之比等于各物质的物质的量的变化量之比,即X、Y、Z变化量之比为:(3-2.4):(1.5-1.2):(0.6-0)=2:1:2,所以反应为:2X+Y?2Z,故答案为:2X+Y?2Z;
②0~6min内用X的浓度变化表示的平均反应速度为v=$\frac{△c}{△t}$=$\frac{\frac{3.0mol-2.4mol}{2L}}{6min}$=0.05mol•L-1•min-1,故答案为:0.05mol•L-1•min-1;
③第4min时,各物质的量的变化量迅速增大,反应速率加快,所以改变的条件是加入催化剂或是升高温度,故答案为:升高温度或加入催化剂.
点评 该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,综合考查学生对知识的综合应用能力.

练习册系列答案
相关题目
5.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4混中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
20.下列实验操作、现象和结论正确的是( )


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②振荡后静止 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③旋开活塞 | 观察到红色喷泉 | NH3极易溶于水,氨水显碱性 |
| D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
| A. | A | B. | B | C. | C | D. | D |
13.下列化学实验能达到目的是( )
| A. | 用激光笔检验某KI溶液中是否溶有淀粉 | |
| B. | 加热可除去NaHCO3固体中的Na2CO3杂质 | |
| C. | 向碘水中加入苯或酒精,均可从碘水中萃取碘 | |
| D. | 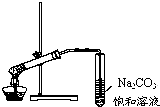 用如图所示的装置制取少量的乙酸乙酯 |
14.下列表述正确的是( )
| A. | 羟基的电子式: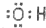 | B. | 1-丁烯的键线式  | ||
| C. | 醛基的结构简式-COH | D. | 聚丙烯的结构简式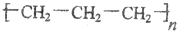 |
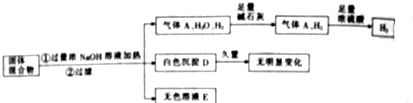


 (1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.
(1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.