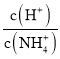��Ŀ����
����Ŀ����ɫ����ˮ����KaCub(C2O4)c��H2O(ͭԪ��Ϊ+2��)����ɿ�ͨ������ʵ��ȷ����
����٣���ȡһ����������Ʒ������ƿ�У���������2 mol��L-1ϡ���ᣬ��ʹ��Ʒ�ܽ⡣�ټ���30 mLˮ���ȣ���0.0200 mol��L-1KMnO4��Һ�ζ����յ㣬����KMnO4��Һ12.00 mL(![]() �Ļ�ԭ����ΪMn2+)��
�Ļ�ԭ����ΪMn2+)��
����ڣ���ּ��ȵζ������Һ����ȴ����pH�����������KI���壬��Һ��Ϊ��ɫ��������ɫ����CuI��������Ӧ2Cu2++4I-=2CuI��+I2
����ۣ���������������Һ��ָʾ������0.0200 mol��L-1Na2S2O3����Һ�ζ����յ㣬���ı���Һ15.00 mL��������ӦI2+2![]() =2I-+
=2I-+![]()
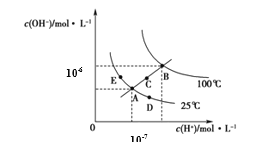
(1)���������δ�Եζ������Һ���м��ȣ�������Cu2+�����ʵ�����____(����ƫ��������ƫС�� ����������) ��
(2)������еζ��յ��������___________��
(3)ͨ������ȷ��a��b��c=___________��(д���������)
���𰸡�ƫ�� ��Һ��ɫ��ȥ 2��1��2
��������
(1)���ȿɴ�ʹMnO4-�ֽ����Mn2+��Ӧ������Ժ���ʵ��������ţ�
(2)����I2��������Һ��Ϊ��ɫ�жϵζ��յ��ʵ������
(3)����MnO4-����Һ�����ʵ�������C2O42-�����ʵ��������ݷ�Ӧ����Na2S2O3����Һ���������Cu2+�����ʵ����������ݵ���غ�ɼ���K+�����ʵ������ټ�����������ӵ����ʵ����������ȣ����õ�a��b��c�ı�ֵ��
(1)������������KMnO4����ǿ�������ԣ�������I-����������ԭ��Ӧ����I2�����������δ�Եζ������Һ���м��ȳ�ȥMnO4-��MnO4-����������Ϊ�ⶨCu2+�������I-����Ӧ����I2��ʹ����I2�����ʵ������࣬���²����Cu2+�ĺ���ƫ��
(2)����Һ�з�����Ӧ��2Cu2++4I-=2CuI��+I2���Ե�����Һ��ָʾ��������I2��������Һ��Ϊ��ɫ��������0.0200 mol��L-1Na2S2O3����Һ���еζ�ʱ��������Ӧ��I2+2S2O32-=2I-+S4O62-�����ű���Һ�ļ��룬I2Ũ�����ͣ���Һ��ɫ��dz�����μ����һ��Na2S2O3����Һʱ����Һǡ������ɫ��Ϊ��ɫ���Ұ�����ڲ��ٱ�Ϊ��ɫ��˵����ʱ��Ӧ�ﵽ�˵ζ��յ�ʵζ��յ��ʵ�������ǣ���Һ��ɫ��ȥ��������ڲ��ٱ�Ϊ��ɫ��
(3)���ݵ����غ��֪��ϵʽ��5C2O42-��2MnO4-������n(C2O42-)=![]() n(MnO4-)=
n(MnO4-)=![]() ��0.0200 mol/L��12.00 mL��10-3 L/mL=6.000��10-4 mol��
��0.0200 mol/L��12.00 mL��10-3 L/mL=6.000��10-4 mol��
���ݷ���ʽ2Cu2++4I-=2CuI��+I2��I2+2S2O32-=2I-+S4O62-���ɵù�ϵʽ��2Cu2+��I2��2S2O32-������n(Cu2+)=2n(I2)=n(S2O32-)=0.0200 mol/L��15.00 mL��10-3 L/mL=3.000��10-4 mol��
���ݵ���غ�ɵã�
n(K+)+2n(Cu2+)=2n(C2O42-)����n(K+)+2��3.000��10-4 mol=2��6.000��10-4 mol�����n(K+)=6.000��10-4 mol������n(K+)��n(Cu2+)��n(C2O42-)=2��1��2����a��b��c=2��1��2��

����Ŀ��100��ʱ���ڲ�ͬ�������Ӵ����£��������⾭��24h�ķֽ������±���ʾ��
���� | ��������mg��L��1�� | �ֽ���/% | ���� | ��������mg��L��1�� | �ֽ���/% |
�� |
| 2 | Fe2�� | 1.0 | 15 |
Al3�� | 10 | 2 | Cu2�� | 0.1 | 86 |
Zn2�� | 10 | 10 | Cr3�� | 0.1 | 96 |
�����й�˵����ȷ����
A.��ʹ��������ֽⷴӦ��ܽ�������������Al3��
B.��������ʹƽ���ƶ�����߹�������ķֽ���
C.������������м���ˮ����������ķֽ����ʼӿ�
D.�õ���H2O2��O2ʱ���������ֽ���ȣ�������������KMnO4��Һ�ɵõ�����O2