题目内容
【题目】100℃时,在不同金属离子存在下,过氧化氢经过24h的分解率如下表所示:
离子 | 加入量(mg·L-1) | 分解率/% | 离子 | 加入量(mg·L-1) | 分解率/% |
无 |
| 2 | Fe2+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
下列有关说法正确的是
A.能使过氧化氢分解反应活化能降低最多的离子是Al3+
B.催化剂可以使平衡移动,提高过氧化氢的分解率
C.若向过氧化氢中加入水,过氧化氢的分解速率加快
D.用等量H2O2制O2时,与自身分解相比,加入足量酸性KMnO4溶液可得到更多O2
【答案】D
【解析】
A.根据表格数据可知,相同时间内,加入Cr3+的量最少,而过氧化氢的分解率最大,即该时段内加入Cr3+的反应速率最快,活化能降低最多,故A错误;
B.催化剂不能改变反应的平衡,只能改变反应速率,故B错误;
C.加水会使过氧化氢的浓度减小,分解速率减慢,故C错误;
D.过氧化氢分解产生氧气时发生自身的氧化还原反应,有一半氧被还原,而利用足量酸性KMnO4溶液和过氧化氢反应制取氧气时,过氧化氢中的氧元素几乎全部被氧化(考虑到有部分过氧化氢分解),产生的氧气更多,故D正确;
综上所述答案为D。

 同步奥数系列答案
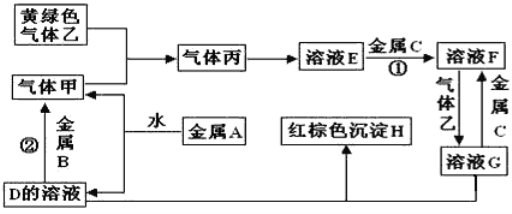
同步奥数系列答案【题目】新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。

已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ | 20 | 40 | 60 |
溶解度/g | 6.2 | 23.4 | 48.3 |
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
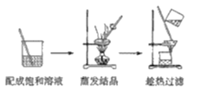
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
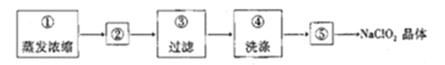
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为![]() +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,![]() ),
),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。