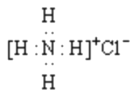题目内容
【题目】X、Y、Z、M、N是原子序数依次增大的五种短周期主族元索,它们能形成一种有机酸(结构如图),五种元素原子的最外层电子数之和为24,Z和N同主族,M是非金属性最强的元素,下列说法错误的是
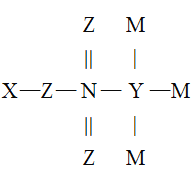
A.最高正化合价:N>Y>X
B.Z、N可分别与X形成等电子数的化合物
C.原子半径:N>Z>Y>M>X
D.Y和N均存在某种含氧酸能使酸性KMnO4溶液褪色
【答案】C
【解析】
X、Y、Z、M、N是原子序数依次增大的五种短周期主族元索,它们能形成一种有机酸(结构如图),Z可形成2对共用电子对,N可形成6对共用电子对,Z和N同主族,则它们应位于第VIA族,则Z为O元素,N为S元素;M是非金属性最强的元素,则M为F元素;Y可形成4对共用电子对,且原子序数小于O,则Y为C元素;X形成1对共用电子对,则X为H元素,这五种元素原子的最外层电子数之和为24,据此分析解答。
由以上分析知,X为H元素,Y为C元素,Z为O元素,M为F元素,N为S元素,
A. S、C、H元素的最高正化合价分别为+6、+4、+1,则最高正化合价:N>Y>X,故A正确;
B. O、S可分别与H形成化合物H2O2、H2S,二者均为18电子化合物,故B正确;
C. 同周期原子半径从左向右依次减小,同主族从上往下原子半径依次增大,故原子半径:S>C>O>F>H,即N>Y>Z>M>X,故C错误;
D. C和S均存在某种含氧酸能使酸性KMnO4溶液褪色,如H2C2O4、H2SO3等均能被酸性KMnO4溶液氧化,从而使酸性KMnO4溶液褪色,故D正确;
故选C。

【题目】新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。

已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ | 20 | 40 | 60 |
溶解度/g | 6.2 | 23.4 | 48.3 |
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
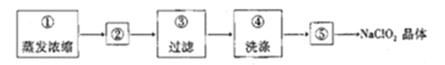
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为![]() +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,![]() ),
),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。