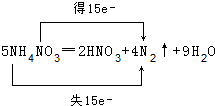
题目内容
20.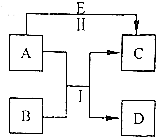 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式 .
.
分析 若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气,可知B为Na202,反应I为过氧化钠和二氧化碳的反应,A为C02,D为单质,应为02,C为Na2CO3,则由转化关系可知E为NaOH,以此解答该题.
解答 解:若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气,可知B为Na202,反应I为过氧化钠和二氧化碳的反应,A为C02,D为单质,应为02,C为Na2CO3,则由转化关系可知E为NaOH,A为C02,为共价化合物,电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意把握置换反应的特点,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
10.下列分子中含有手性碳原子的是( )
| A. | CF2Cl2 | B. |  | ||
| C. | CH3CH2CHClCH2CH2CH3 | D. | CH2═CH-COOH |
11.由CH4和O2组成的混合气体,标准状况下的密度为1g•L-1,则该混合气体中CH4和O2的质量比为( )
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
8.在一定条件下的密闭容器中发生反应:N2O4(g)?2NO2(g),经1min后反应达到平衡,c(N2O4)从0.100mol•L-1降为0.040mol•L-1,下列有关说法中,不正确的是( )
| A. | 1min内的平均反应速率v(N2O4)为0.060mol•L-1•min-1 | |
| B. | 若容器的体积为1L,则反应经0.5min后容器内n(NO2)为0.060mol | |
| C. | 反应达到平衡前,2v(N2O4)=v(NO2) | |
| D. | 反应达到平衡时,2v(N2O4)=v(NO2) |
15.下列反应属于一种元素还原两种元素的是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2(FeS2中S为-1) | |
| C. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2(HgS中S为-2价) | |
| D. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ |
12.以下关于化学反应KClO3+6HCl═KCl2+3H20中,电子转移的方向和数目的叙述正确的是( )
| A. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | B. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- | ||
| C. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | D. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- |
14.下列说法正确的是( )
| A. | 摩尔是一个物理量,含6.02×1023个粒子 | |
| B. | 物质的量是国际单位制的七个基本单位之一 | |
| C. | 摩尔既是物质的量的单位,又是粒子的数量单位 | |
| D. | 摩尔的基准是0.012 Kg 12C中所含的碳原子数 |