题目内容
10.下列分子中含有手性碳原子的是( )| A. | CF2Cl2 | B. |  | ||
| C. | CH3CH2CHClCH2CH2CH3 | D. | CH2═CH-COOH |
分析 根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的.
解答 解:A、CCl2F2中碳原子所连接的四个基团有2个是一样的,该碳原子没有手性,故A错误;
B、 中的碳原子都没有手性,故B错误;
中的碳原子都没有手性,故B错误;
C、CH3CH2CHClCH2CH2CH3中第三个碳原子连接了四个不同的原子和原子团,该碳原子具有手性,故C正确;
D、CH2═CH-COOH中三个碳原子都为不饱和碳原子,碳原子没有手性,故D错误;
故选C.
点评 本题主要考查手性碳原子的判断,手性碳原子判断注意:手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同的,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
20.化学实验室中常将溶液或试剂进行酸化,下列酸化处理正确的是( )
| A. | 定量检验C2H5Cl时,将C2H5Cl和NaOH溶液混合共热后,加盐酸酸化 | |
| B. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 | |
| C. | 鉴定检测液中是否有Fe2+时,用硝酸酸化,再加KSCN溶液 | |
| D. | 鉴别溶液中是否含有SO42-可用盐酸酸化 |
1.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒.有少量因爆炸冲击发生泄漏.这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染.
(1)写出NaCN的电子式Na+ ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
(1)写出NaCN的电子式Na+
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
18.下列微粒中,中心原子含有孤电子对的是( )
| A. | SiH4 | B. | CCl4 | C. | H2O | D. | NH4+ |
5.铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A. | 不锈钢是铁合金,只含金属元素 | |
| B. | 生铁的含碳量比钢高 | |
| C. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| D. | 铁合金的熔点低于纯铁的熔点 |
15.下列关于物质的检验说法正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- |
2.下列说法正确的是( )
| A. | 电池充电时其正极应与外电源的负极相连而成为阴极 | |
| B. | 氢氧燃料电池(碱性介质)的正极反应式:O2+4e-→2O2- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜 | |
| D. | 铁件上镀铜时,将铁件与电源的负极相连 |
19.下列物质中分子数最多的是( )
| A. | 标准状况下134.4LNH3 | B. | 132g CO2 | ||
| C. | 标准状况下108 mL 水 | D. | 6.02×1024个氢分子 |
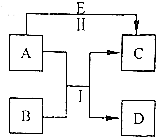 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式 .
.