题目内容
5.(1)分析反应5NH4NO3═2HNO3+4N2↑+9H2O的电子转移方向和数目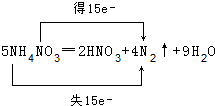
(2)在上述反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是5:3.
(3)在上述反应中每生成1mol硝酸生成N2的体积为44.8L.(标准状况)
分析 (1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子;
(2)反应中只有氮元素化合价变化,发生氧化反应的氮原子化合价由-3价升高为0价,发生还原反应的氮原子由+5价降低为0价,根据电子转移守恒计算;
(3)根据5NH4NO3═2HNO3+4N2↑+9H2O计算;
解答 解:(1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,用双线桥表示该反应电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)反应中只有氮元素化合价变化,发生氧化反应的即被氧化的N元素化合价由-3价升高为0价,发生还原反应的即被还原的氮元素由+5价降低为0价,根据电子转移守恒,被氧化与被还原的N原子个数之比为5:3,故答案为:5:3;
(3)由5NH4NO3═2HNO3+4N2↑+9H2O反应,则每生成1mol硝酸生成2molN2即在标准状况的体积为2×22.4=44.8L,故答案为:44.8.
点评 本题考查氧化还原反应、物质的量有关计算,难度不大,侧重对基础知识的巩固,注意掌握单线桥、双线桥表示电子转移.

练习册系列答案
相关题目
15.下列关于物质的检验说法正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- |
16.用NA代表阿伏加德罗常数,下列表述正确的是( )
| A. | 1L0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 1mol羟基中电子数为10 NA |
19.二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4,还含有少量的Fe203、Al2O3、SiO2等杂质)为原料制备二氧化锆(ZrO2)的工艺流程如图所示.
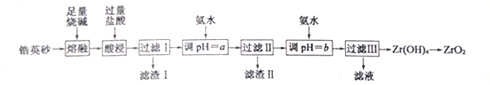
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:
(1)经熔融后,锆英砂中Zr元素以Na2ZrO3(写化学式)形式存在.
(2)写出酸浸时生成Al3+、Fe3+的离子方程式Fe2O3+6H+=Fe3++3H2O,AlO2-+4H+=Al3++2H2O.
(3)滤渣Ⅰ的主要成分的名称为硅酸.
(4)向过滤Ⅱ所得滤液中加氨水调pH=b,则b的范围是5.2~6.2.
(5)向过滤Ⅲ所得的滤液中加入CaCO3粉末并加热,可得到CO2和另一种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(6)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.在熔融电解质中,O2-向负(填“正”或“负”)极移动.负极电极反应为:C4H10-26e-+13O2-=4CO2+5H2O.

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:
| 离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 完全沉淀时pH | 3.2 | 5.2 | 8.0 |
(2)写出酸浸时生成Al3+、Fe3+的离子方程式Fe2O3+6H+=Fe3++3H2O,AlO2-+4H+=Al3++2H2O.
(3)滤渣Ⅰ的主要成分的名称为硅酸.
(4)向过滤Ⅱ所得滤液中加氨水调pH=b,则b的范围是5.2~6.2.
(5)向过滤Ⅲ所得的滤液中加入CaCO3粉末并加热,可得到CO2和另一种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(6)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.在熔融电解质中,O2-向负(填“正”或“负”)极移动.负极电极反应为:C4H10-26e-+13O2-=4CO2+5H2O.
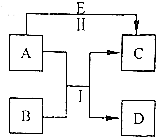 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式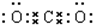 .
.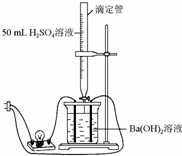 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下: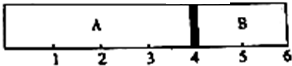 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.