题目内容
【题目】(1)按要求写出下列反应的化学方程式:
①由饱和FeCl3溶液制备Fe(OH)3胶体_______________________________。
②氢氟酸腐蚀玻璃____________________________________。
(2)按要求写出下列反应的离子方程式:
①制漂白粉(有效成分为次氯酸钙)____________________________________。
②用硫氰化钾溶液检验溶液中含有Fe3+____________________________________。
③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性____________________________________。向以上中性溶液中继续滴加Ba(OH)2溶液,写出此步的离子方程式_______________________________。
【答案】 FeCl3+3H2O![]() Fe(OH)3(胶体) +3HCl SiO2+4HF==SiF4↑+ 2H2O Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O Fe3++3SCN-==Fe(SCN)3 2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O Ba2++ SO42-==BaSO4↓
Fe(OH)3(胶体) +3HCl SiO2+4HF==SiF4↑+ 2H2O Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O Fe3++3SCN-==Fe(SCN)3 2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O Ba2++ SO42-==BaSO4↓
【解析】(1)①由饱和FeCl3溶液制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体) +3HCl。②氢氟酸腐蚀玻璃时与二氧化硅反应,方程式为SiO2+4HF==SiF4↑+ 2H2O。(2)①制漂白粉利用的是氯气与石灰乳反应,离子方程式为Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O。②用硫氰化钾溶液检验溶液中含有Fe3+的离子方程式为Fe3++3SCN-==Fe(SCN)3。③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性时生成硫酸钡、硫酸钠和水,离子方程式为2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O。向以上中性溶液中继续滴加Ba(OH)2溶液又产生硫酸钡沉淀,反应的离子方程式为Ba2++SO42-==BaSO4↓。
Fe(OH)3(胶体) +3HCl。②氢氟酸腐蚀玻璃时与二氧化硅反应,方程式为SiO2+4HF==SiF4↑+ 2H2O。(2)①制漂白粉利用的是氯气与石灰乳反应,离子方程式为Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O。②用硫氰化钾溶液检验溶液中含有Fe3+的离子方程式为Fe3++3SCN-==Fe(SCN)3。③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性时生成硫酸钡、硫酸钠和水,离子方程式为2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O。向以上中性溶液中继续滴加Ba(OH)2溶液又产生硫酸钡沉淀,反应的离子方程式为Ba2++SO42-==BaSO4↓。

【题目】氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为 . 可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H= .
化学键 | 键能/(kJmol﹣1) |
N﹣H | 391.3 |
Cl﹣Cl | 243.0 |
N﹣Cl | 191.2 |
H﹣Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 .
(2)用焦炭还原NO的反应为:2NO(g)+C(s)N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)= .
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: 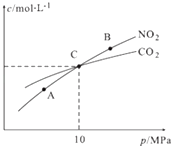
② A,B两点的浓度平衡常数关系:Kc(A)Kc(B)(填“<”或“>”或“=”).
②A,B,C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32﹣、Ba2+、SO42﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液,反应后进行( )、( )、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是;
(2)写出实验3中的空格处的实验操作;
(3)根据实验对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围(若“一定不存在”或“不能确定”不填此空).
【题目】实验室以正丁醇、溴化钠、硫酸为原料制备正溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下: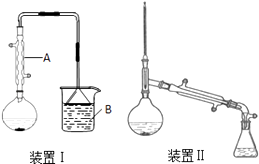
物质 | 正丁醇 | 正溴丁烷 |
沸点/℃ | 117.2 | 101.6 |
熔点/℃ | ﹣89.12 | ﹣112.4 |
密度/gcm﹣3 | 0.8098 | 1.2758 |
溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
将所得粗产品倒入分液漏斗中,先用10mL水洗涤,除去大部分水溶性杂质,然后依次用5mL浓硫酸、10mL水、10mL饱和NaHCO3溶液、10mL水洗涤.分离出有机层,加入无水氯化钙固体,静置1h,过滤除去氯化钙,再常压蒸馏收集99~103℃馏分.
回答下列问题:
(1)仪器A的名称是 , 冷却水从A的(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是(填化学式).本实验使用电热套进行加热,总共使用了次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是 .
(6)本实验得到正溴丁烷6.5g,产率为(只列式,不必计算出结果).
【题目】乙苯催化脱氢生产苯乙烯的反应:![]()
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体物质的量总和为 mol,乙苯的转化率为
②列式计算此温度下该反应的平衡常数K
(2)根据化学反应原理,分析减小压强对该反应的影响
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]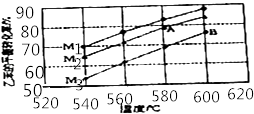
比较图中A,B两点对应平衡常数大小:KAKB
②图中投料比(M1、M2、M3)的大小顺序为
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是(用化学方程式表示)
【题目】在不同温度下,将2mol X,2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)mZ(g)△H,所得Z的平衡浓度如表所示,下列说法正确的是( )
| 1 | 2 | 3 |
200 |
|
|
|
300 | 2.4 | 1.2 | 0.8 |
400 | 2.0 | 1.0 |
|
A.m=2,△H>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大