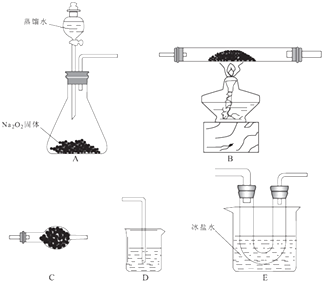
ЬтФПФкШн
ЁОЬтФПЁПЕЊЕФЛЏКЯЮядкЩњВњЩњЛюжаЙуЗКДцдкЃЎ
ЃЈ1ЃЉЂйТШАЗЃЈNH2ClЃЉЕФЕчзгЪНЮЊ ЃЎ ПЩЭЈЙ§ЗДгІNH3ЃЈgЃЉ+Cl2ЃЈgЃЉ=NH2ClЃЈgЃЉ+HClЃЈgЃЉжЦБИТШАЗЃЌвбжЊВПЗжЛЏбЇМќЕФМќФмШчЯТБэЫљЪОЃЈМйЖЈВЛЭЌЮяжЪжаЭЌжжЛЏбЇМќЕФМќФмвЛбљЃЉЃЌдђЩЯЪіЗДгІЕФЁїH= ЃЎ
ЛЏбЇМќ | МќФм/ЃЈkJmolЉ1ЃЉ |
NЉH | 391.3 |
ClЉCl | 243.0 |
NЉCl | 191.2 |
HЉCl | 431.8 |
ЂкNH2ClгыЫЎЗДгІЩњГЩЧПбѕЛЏадЕФЮяжЪЃЌПЩзїГЄаЇЛКЪЭЯћЖОМСЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЎ
ЃЈ2ЃЉгУНЙЬПЛЙдNOЕФЗДгІЮЊЃК2NOЃЈgЃЉ+CЃЈsЃЉN2ЃЈgЃЉ+CO2ЃЈgЃЉЃЌЯђШнЛ§ОљЮЊ1LЕФМзЁЂввЁЂБћШ§ИіКуШнКуЮТЃЈЗДгІЮТЖШЗжБ№ЮЊ400ЁцЁЂ400ЁцЁЂTЁцЃЉШнЦїжаЗжБ№МгШызуСПЕФНЙЬПКЭвЛЖЈСПЕФNOЃЌВтЕУИїШнЦїжаnЃЈNOЃЉЫцЗДгІЪБМфtЕФБфЛЏЧщПіШчЯТБэЫљЪОЃК
t/min | 0 | 40 | 80 | 120 | 160 |
nЃЈNOЃЉЃЈМзШнЦїЃЉ/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
nЃЈNOЃЉЃЈввШнЦїЃЉ/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
nЃЈNOЃЉЃЈБћШнЦїЃЉ/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
ЂйИУЗДгІЮЊЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЗДгІЃЎ
ЂкввШнЦїдк200minДяЕНЦНКтзДЬЌЃЌдђ0ЁЋ200minФкгУNOЕФХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪvЃЈNOЃЉ= ЃЎ
ЃЈ3ЃЉгУНЙЬПЛЙдNO2ЕФЗДгІЮЊЃК2NO2ЃЈgЃЉ+2CЃЈsЃЉN2ЃЈgЃЉ+2CO2ЃЈgЃЉЃЌдкКуЮТЬѕМўЯТЃЌ1mol NO2КЭзуСПCЗЂЩњИУЗДгІЃЌВтЕУЦНКтЪБNO2КЭCO2ЕФЮяжЪЕФСПХЈЖШгыЦНКтзмбЙЕФЙиЯЕШчЭМЫљЪОЃК 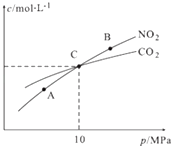
Ђк AЃЌBСНЕуЕФХЈЖШЦНКтГЃЪ§ЙиЯЕЃКKcЃЈAЃЉKcЃЈBЃЉЃЈЬюЁАЃМЁБЛђЁАЃОЁБЛђЁА=ЁБЃЉЃЎ
ЂкAЃЌBЃЌCШ§ЕужаNO2ЕФзЊЛЏТЪзюИпЕФЪЧЃЈЬюЁАAЁБЛђЁАBЁБЛђЁАCЁБЃЉЕуЃЎ
ЂлМЦЫуCЕуЪБИУЗДгІЕФбЙЧПЦНКтГЃЪ§KpЃЈCЃЉ=ЃЈKpЪЧгУЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЌЗжбЙ=змбЙЁСЮяжЪЕФСПЗжЪ§ЃЉЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉ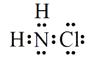 ЃЛ+11.3kJ?molЉ1ЃЛNH2Cl+H2O?NH3+HClO
ЃЛ+11.3kJ?molЉ1ЃЛNH2Cl+H2O?NH3+HClO
ЃЈ2ЃЉЗХШШЃЛ0.003mol?LЉ1?minЉ1
ЃЈ3ЃЉ=ЃЛAЃЛ2MPa
ЁОНтЮіЁПНтЃКЃЈ1ЃЉЂйТШАЗПЩПДзїЪЧАБЦјЗжзгЩЯвЛИіЧтдзгБЛТШдзгШЁДњЕФНсЙЙЃЌдђТШАЗЕФЕчзгЪНЮЊЃК 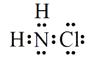 ЃЛNH3ЃЈgЃЉ+Cl2ЃЈgЃЉ=NH2ClЃЈgЃЉ+HClЃЈgЃЉЃЌЁїH=ЗДгІЮяЕФМќФмжЎКЭЉЩњГЩЮяЕФМќФмжЎКЭ=ЃЈ3ЁС391.3+243.0ЃЉЉЃЈ2ЁС391.3+191.2+431.8ЃЉ=+11.3 kJmolЉ1ЃЛ ЫљвдД№АИЪЧЃК
ЃЛNH3ЃЈgЃЉ+Cl2ЃЈgЃЉ=NH2ClЃЈgЃЉ+HClЃЈgЃЉЃЌЁїH=ЗДгІЮяЕФМќФмжЎКЭЉЩњГЩЮяЕФМќФмжЎКЭ=ЃЈ3ЁС391.3+243.0ЃЉЉЃЈ2ЁС391.3+191.2+431.8ЃЉ=+11.3 kJmolЉ1ЃЛ ЫљвдД№АИЪЧЃК 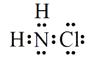 ЃЛ+11.3 kJmolЉ1ЃЛ
ЃЛ+11.3 kJmolЉ1ЃЛ
ЂкNH2ClгыЫЎЗДгІЩњГЩЧПбѕЛЏадЕФЮяжЪЃЌПЩзїГЄаЇЛКЪЭЯћЖОМСЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊNH2Cl+H2ONH3+HClOЃЛ
ЫљвдД№АИЪЧЃКNH2Cl+H2ONH3+HClOЃЛ
ЁЄЃЈ2ЃЉЂйБћШнЦїгыМзШнЦїЭЖШыСПЯрЭЌЃЌДяЕНЦНКтЫљгУЪБМфНЯЖЬЃЌЫЕУїБћШнЦїЮТЖШНЯИпЃЌБћШнЦїЦНКтЪБNOЕФХЈЖШБШМзШнЦїИпЃЌЫЕУїЮТЖШЩ§ИпКѓЯђзХФцЗНЯђвЦЖЏЃЌМДФцЗНЯђЮЊЮќШШЗНЯђЃЌИУЗДгІЪЧИіЗХШШЗДгІЃЛ
ЫљвдД№АИЪЧЃКЗХШШЃЛ
ЂкИљОн2NOЃЈgЃЉ+CЃЈsЃЉN2ЃЈgЃЉ+CO2ЃЈgЃЉЃЌЧАКѓЦјЬхЬхЛ§ВЛБфЃЌЯрЭЌЮТЖШЯТЃЌМзгыввЮЊЕШаЇЦНКтЃЌЙЪввЦНКтЪБNOЕФЮяжЪЕФСПЮЊМзЦНКтЪБЕФвЛАыЃЌЮЊ0.4molЃЌдђ0ЁЋ200minФкгУNOЕФХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪvЃЈNOЃЉ= ![]() =0.003 molLЉ1minЉ1ЃЛ
=0.003 molLЉ1minЉ1ЃЛ
ЫљвдД№АИЪЧЃК0.003 molLЉ1minЉ1ЃЛ
ЁЄЃЈ3ЃЉЂйAЁЂBСНЕуЕФЮТЖШЯрЭЌЃЌЦНКтГЃЪ§KжЛгыЮТЖШгаЙиЃЌЙЪХЈЖШЦНКтГЃЪ§ЙиЯЕЃКKcЃЈAЃЉ=KcЃЈBЃЉЃЛ
ЫљвдД№АИЪЧЃК=ЃЛЂкЗДгІ2NO2ЃЈgЃЉ+2CЃЈsЃЉN2ЃЈgЃЉ+2CO2ЃЈgЃЉЪЧИіЦјЬхЬхЛ§діДѓЕФЗДгІЃЌдіДѓбЙЧПЦНКтФцЯђвЦЖЏЃЌЙЪAЁЂBЁЂCШ§ЕужаNO2ЕФзЊЛЏТЪзюИпЕФЪЧAЕуЃЛ
ЫљвдД№АИЪЧЃКAЃЛЂл1mol NO2КЭзуСПCЗЂЩњИУЗДгІЃЌЩшЗДгІЖўбѕЛЏЕЊxЃЌСаШ§ЖЮЪНЃК
2NO2ЃЈgЃЉ+ | 2CЃЈsЃЉ | N2ЃЈgЃЉ+ | 2CO2ЃЈgЃЉ | ||
nЪМЃК | 1 | 0 | 0 | ||
nзЊЃК | x | 0.5x | x | ||
nЦНЃК | 1Љx | 0.5x | x |
ДгЭМжЊCЕуЪБNO2КЭCO2ЕФЮяжЪЕФСПХЈЖШЃЌдђ1Љx=xЃЌНтЕУx=0.5ЃЌдђЦНКтЪБзмЕФЮяжЪЕФСПЮЊ1.25molЃЌCЕуЪБИУЗДгІЕФбЙЧПЦНКтГЃЪ§KpЃЈCЃЉ= 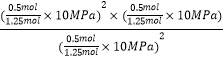 =2MPaЃЛ
=2MPaЃЛ
ЫљвдД№АИЪЧЃК2 MPaЃЛ
ЁОПМЕуОЋЮіЁПНтД№ДЫЬтЕФЙиМќдкгкРэНтЛЏбЇЦНКтЕФМЦЫуЕФЯрЙижЊЪЖЃЌеЦЮеЗДгІЮязЊЛЏТЪ=зЊЛЏХЈЖШЁТЦ№ЪМХЈЖШЁС100%=зЊЛЏЮяжЪЕФСПЁТЦ№ЪМЮяжЪЕФСПЁС100%ЃЛВњЦЗЕФВњТЪ=ЪЕМЪЩњГЩВњЮяЕФЮяжЪЕФСПЁТРэТлЩЯПЩЕУЕНВњЮяЕФЮяжЪЕФСПЁС100%ЃЎ

 бЇЦкИДЯАвЛБОЭЈбЇЯАзмЖЏдБЦкФЉМгЪюМйбгБпШЫУёГіАцЩчЯЕСаД№АИ
бЇЦкИДЯАвЛБОЭЈбЇЯАзмЖЏдБЦкФЉМгЪюМйбгБпШЫУёГіАцЩчЯЕСаД№АИ УЂЙћНЬИЈЪюМйЬьЕижиЧьГіАцЩчЯЕСаД№АИ
УЂЙћНЬИЈЪюМйЬьЕижиЧьГіАцЩчЯЕСаД№АИЁОЬтФПЁП1000mlФГЮоЩЋД§ВтвКжаГ§КЌга0.2molLЉ1ЕФNa+ЭтЃЌЛЙПЩФмКЌгаЯТСаРызгжаЕФвЛжжЛђЖржжЃК
бєРызг | K+ЁЂNH4+ЁЂFe3+ЁЂBa2+ |
вѕРызг | ClЉЁЂCO32ЉЁЂHCO3ЉЁЂSO42Љ |
ЯжНјааШчЯТЪЕбщВйзїЃЈЫљМгЪдМСОљЙ§СПЃЉЃКЃЈвбжЊЃКNH4++OHЉЃЈХЈЃЉ=NH3Ёќ+H2OЃЉ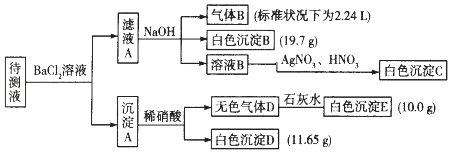
ЃЈ1ЃЉдШмвКжаПЯЖЈДцдкЕФРызгЪЧЃЈГ§Na+ЃЉ ЃЌ ПЯЖЈВЛДцдкЕФРызгЪЧ ЃЎ
ЃЈ2ЃЉаДГіЩњГЩАзЩЋГСЕэBЕФРызгЗНГЬЪНЃК ЃЎ аДГіГСЕэAШмгкЯЁЯѕЫсЕФРызгЗНГЬЪНЃК ЃЎ
ЃЈ3ЃЉНЋТЫвКAКЭГСЕэAЗжПЊЕФВйзїЪЧЙ§ТЫЃЌЯДЕгЃЎЯДЕгЕФВйзїЪЧ ЃЎ