题目内容
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
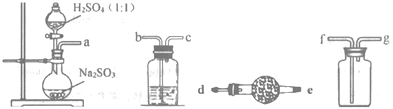
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。
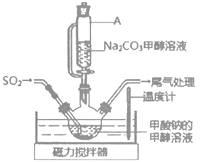
①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
【答案】b c f g d Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O +3 恒压滴液漏斗 排净系统中的空气 向漏斗中加入甲醇或乙醇至浸没晶体,待甲醇顺利流下,重复2-3次 ![]()
【解析】
(1)亚硫酸钠和硫酸反应生成二氧化硫,反应的方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,生成的二氧化硫含有水蒸气,可用浓硫酸干燥,用向上排空气法收集,且用碱石灰吸收尾气,避免污染环境,则连接顺序为a接b,c接f,g接d;
(2)①Na2S2O4中硫元素的化合价为+3;
②由装置可知,仪器A的名称为恒压滴液漏斗;
③实验时应避免Na2S2O4和HCOONa被氧化,可应先通入二氧化硫,排净系统中的空气,防止加热时Na2S2O4和HCOONa被氧化,也可通一段时间N2,排净系统中的空气;
④洗涤连二亚硫酸钠时应与空气隔离,洗涤剂可用甲醇或乙醇,洗涤过程为:在无氧环境中,向漏斗中加入甲醇或乙醇至浸没晶体,待甲醇顺利流下,重复2-3次;
⑤设连二亚硫酸钠理论产率为x,根据硫原子守恒:
2Na2SO3 ~ Na2S2O4
252 174
6.3g x
则![]() ,解得x=4.35g,产率为:
,解得x=4.35g,产率为:![]()

 阅读快车系列答案
阅读快车系列答案