题目内容
【题目】氯磺酰氰酯(结构简式为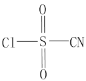 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为__________,组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为__________
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是__________、__________, 1个氯磺酰氰酯分子中含有σ键的数目为__________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为__________。
(3)ClO4-的空间构型为__________
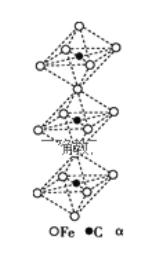
(4)一种由铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为__________
【答案】1s22s22p63s23p63d74s2Na<H<Cl<Osp3sp5N>O>Cl>C>S 正四面体Fe3C
【解析】
(1)钴原子核外有27个电子,根据能量最低原理书写钴原子核外电子排布式;元素非金属性越强电负性越大;(2)根据氯磺酰氰酯分子的结构简式,硫原子形成4个σ键,C原子形成2个σ键,分子中相邻原子间都有1个σ键;同周期从左到右,总趋势是第一电离能由小变大,但V A族因为其p轨道达到半满状态比较稳固,所以第一电离能比ⅥA族大,同主族元素从上到下第一电离能减小,所以C,N,O,S,Cl第一电离能从大到小的顺序是N>O>Cl>C>S;(3)ClO4-中Cl原子价电子对数是4,无孤对电子;(4)每个碳原子被6个位于顶角位置的铁原子所包围,构成八面体结构,所以八面体结构中含有1个碳原子,每个铁原子又为两个八面体共用,每个八面体结构中有铁原子![]() =3。
=3。
(1)钴原子核外有27个电子,根据能量最低原理,基态钴原子核外电子排布式是1s22s22p63s23p63d74s2;元素非金属性越强电负性越大,所以Na、Cl、O、H电负性由小到大的顺序是Na<H<Cl<O;(2)根据氯磺酰氰酯分子的结构简式,硫原子形成4个σ键,有4个杂化轨道,C原子形成2个σ键,有2个杂化轨道,所以硫原子和碳原子的杂化轨道类型分别是sp3和sp,分子中相邻原子间各有1个σ键,氯磺酰氰酯分子中有5个σ键;同周期从左到右,总趋势是第一电离能由小变大,但VA族因为其p轨道达到半满状态比较稳定,所以第一电离能比ⅥA族大,同主族元素从上到下第一电离能减小,所以C,N,O,S,Cl第一电离能从大到小的顺序是N>O>Cl>C>S;(3)ClO4-中Cl原子价电子对数是4,无孤对电子,所以ClO4-的空间构型为正四面体;(4)每个碳原子被6个位于顶角位置的铁原子所包围,构成八面体结构,所以每个八面体结构中含有1个碳原子,每个铁原子又为两个八面体共用,每个八面体结构中有铁原子![]() =3,所以该化合物的化学式为Fe3C。
=3,所以该化合物的化学式为Fe3C。

 阅读快车系列答案
阅读快车系列答案