题目内容
【题目】实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )
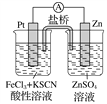
A. 该原电池的正极反应是Zn-2e-===Zn2+
B. 左烧杯中溶液的血红色逐渐褪去
C. 该电池铂电极上有气泡出现
D. 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
【答案】B
【解析】分析:Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,以此解答。
详解:A.Zn失去电子发生氧化反应,为负极反应,A错误;
B.Fe3+在正极得电子被还原为Fe2+,溶液血红色逐渐褪去,B正确;
C.铂电极上Fe3+被还原为Fe2+,没有气体生成,C错误;
D.该电池总反应为:Zn+2Fe3+=2Fe2++Zn2+,没有单质生成,D错误。答案选B。

练习册系列答案
相关题目
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
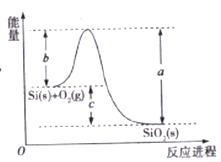
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c