��Ŀ����
����Ŀ������Ϊ����ѧ��Ӧԭ����ѡ��4����
��1��t��ʱ����2molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ��2SO2 (g)+O2(g)![]() 2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
�� �ӷ�Ӧ��ʼ����ѧƽ��״̬������SO3��ƽ����Ӧ����Ϊ_____����ʱ��Ӧ��O2��ת������___________��
�� ����������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����______�����ţ���ͬ����
A��������ѹǿ���ٷ����仯
B. SO2������������ٷ����仯
C. ����������ԭ���������ٷ����仯
D. ��ͬʱ��������2nmol SO2��ͬʱ����n molO2
��t��ʱ������4mol SO2��2mol O2�Ļ������ͨ���������º����ܱ������У���Ӧ���´ﵽƽ��ʱSO2��ת������� �Ƚ�_______����������������������������С������
��2�����г����µ�������Һ��
��0.1mol/LFeC13 ��Һ��_______��������������������������������)��
�� ʵ����0.1mol/LNaHCO3��ҺpH>7����NaHCO3�ĵ���̶�_______ˮ��̶ȣ�������������������������С��������
�� ��0.10mol/L����ͭ��Һ�м�����������ϡ��Һ��ַ�Ӧ��dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c(Cu2+)=_________����֪Ksp[Cu(OH)2]=2.2��10-2O����
��3������ʵ֤����ԭ����з����ķ�Ӧͨ���Ƿ��ȷ�Ӧ���������з�Ӧ�������Ϊԭ��ص���_________��
A. C(s)+H2O(g)=CO(g)+H2(g) ��H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H<0
C.2H2(g)+O2(g)=H2O(l����H<0
�� ��KOH��ҺΪ�������Һ��������ѡ��Ӧ���һ��ԭ��أ���������Ӧʽ��________��
�� ���ԭ���ڹ�ҵ�����Ź㷺��Ӧ�á���ͼ��ʾ�����У�aΪCuSO4��Һ��X��YΪ���Ե缫����Y�缫������Һ��pH�仯��_______��������������������������С������

���𰸡� 0��1mol��L-1��min-1 20% A��B ���� ���� С�� 2.2��10-8mol/L C O2+2H2O+4e-=4OH- ��С
���������ٴﵽƽ��ʱ����Ӧ��O2��ʣ��0.8mol����μӷ�Ӧ�����������ʵ���=(1-0.8)mol=0.2mol�����ݷ���ʽ֪���μӷ�Ӧ�Ķ����������ʵ���Ϊ0.2mol��2=0.4mol�����������������ʵ���Ϊ0.2mol��2=0.4mol�����������������ƽ����Ӧ����=![]() =0.1mol/(Lmin)��O2��ת����=
=0.1mol/(Lmin)��O2��ת����=![]() ��100%=
��100%=![]() ��100%=20%��
��100%=20%��
��A���÷�Ӧǰ���������ʵ�����С����������ѹǿ���ٷ����仯��˵���������ʵ������䣬���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬���������ж�ƽ��״̬������ȷ��B��SO2������������ٷ����仯�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬���������ж�ƽ��״̬������ȷ��C�����۷�Ӧ�Ƿ�ﵽƽ��״̬������������ԭ���������������仯�����Բ��ܸ���ԭ�������ж�ƽ��״̬���ʴ���D�����۷�Ӧ�Ƿ�ﵽƽ��״̬����������ͬʱ��������2nmolSO2��ͬʱ����nmolO2�����Բ��ܾݴ��ж�ƽ��״̬���ʴ��ʴ�ΪAB��
��t��ʱ������4mol SO2��2mol O2�Ļ������ͨ���������º����ܱ������У��൱�ڽ�ԭƽ��״̬�������Сһ�룬��ʱƽ��������У�SO2��ת��������
(2)����Fe3+��ˮ��Һ��Ҫˮ�⣬��0.1mol/LFeC13 ��Һ�����ԣ�
��NaHCO3��Һ��HCO3-�ĵ���̶�С����ˮ��̶ȣ�����0.1mol/LNaHCO3��Һ�Լ��ԣ�
�� Ksp[Cu(OH)2]=c(Cu2+)��c2(OH-)=2.2��10-2O������Һ��pH=8ʱ��c(Cu2+)=(2.2��10-2O)��(1��10-6)2=2.2��10-8mol/L��
(3)��C(s)+H2O(g)=CO(g)+H2(g) ��������ԭ��Ӧ���������ȷ�Ӧ��NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)�Ƿ��ȷ�Ӧ�����Ƿ�������ԭ��Ӧ��C.2H2(g)+O2(g)=H2O(l)��������ԭ��Ӧ��Ҳ�Ƿ��ȷ�Ӧ������Ƴ�ԭ��أ��ʴ�ΪC��
�� ��KOH��ҺΪ�������Һ������������ԭ��Ӧ����������Ӧʽ��O2+2H2O+4e-=4OH-��
��Y�缫Ϊ�����������ĵ缫��ӦΪ4OH--4e-=2H2O+O2�����ٽ�ˮ�ĵ��룬Y�缫��ΧH+������Һ��pH�仯�Ǽ�С��

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�����Ŀ��ʵ���ǻ�ѧ�о�����Ҫ����֮һ��ijͬѧΪ���Ʊ�������̽�����������ʵ�������ʣ������ͼ��ʾ��ʵ�鷽����
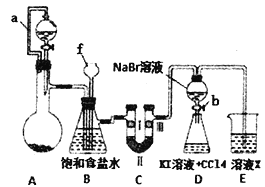
��1������f������___________��
��2��Aװ�õķ�Һ©����ʢװŨ���ᣬ��ƿ�����Ϊ�ظ����(K2Cr207)����ԭ������CrCl3��д��A�����ӷ���ʽ��________________________________��
��3��Bװ�õ����ó���������ȥ�����е��Ȼ������____________��
��4��װ��C��������̽���������Ե������Ƿ�һ����Ư���ԣ���������Լ������______________
������ţ�
�� | �� | �� | �� | |
I | ʪ��ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ʪ��ĺ�ֽ�� |
II | ��ʯ�� | Ũ���� | �轺 | �Ȼ��� |
II! | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� |
��5������Dװ��֤����ķǽ����Աȵ�ǿ��ʵ������ǣ�ʵ����ϣ�_______������ƿ�������� _____________________________________________����������������ʵ�����������
��6��Dװ�ý���ʵ��ʱ���ڵ����Բ�����________________________________��
����Ŀ������п�̵�����ճ����������������ĵ�أ��乹����ͼ��ʾ��
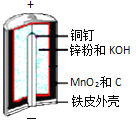
�ŵ�ʱ�ܷ�ӦΪ��Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ������£�
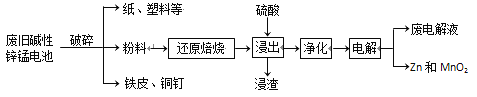
�ش��������⣺
��1��MnOOH�У�MnԪ�صĻ��ϼ�Ϊ________��
��2������ԭ���ա������У��۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO������Ҫԭ���ǡ����ϡ��к���________��
��3������������Ϊ�˳�ȥ����Һ�е�Fe2+�������ǣ�����________���ѧʽ����Һ��Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ������������Ũ��С��1��10��5mol��L��1��Ϊ������ȫ����֪����Һ��Mn2+��Zn2+��Ũ��ԼΪ0.1 mol��L��1�������������ݼ������pH�ĺ�
������________��________��
������ | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP����ֵ | 10��13 | 10��17 | 10��38 |
��4������⡱ʱ�������ĵ缫��ӦʽΪ_____����������Ӧѭ�����õ�������_____���ѧʽ����
��5�����������ϡ�ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2�������ϡ��е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ________��
��6��ij����п�̵��ά�ֵ���ǿ��0.5A���൱��ÿ��ͨ��5��10��6 mol���ӣ�����������80���Ӽ��ӽ�ʧЧ���������һ�ڵ�������п��Ϊ6 g������ʧЧʱ����________%�Ľ���пδ�μӷ�Ӧ��



