题目内容
【题目】氮化钠(Na3N)固体是一种重要的化合物,它与水反应可产生NH3。回答下列问题:
(1)Na3N属于________(填“共价”或“离子”)化合物,Na3N的电子式为________。
(2)Na3N与足量盐酸反应的化学方程式为________。
(3)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或“<”)。
【答案】 离子 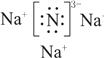 Na3N+4HCl=3NaCl+NH4Cl <
Na3N+4HCl=3NaCl+NH4Cl <
【解析】根据信息,氮化钠(Na3N)与水反应可产生NH3和氢氧化钠。因为钠是活泼金属而氮的非金属性较强,所以氮化钠是离子化合物。
(1)Na3N属于离子化合物,Na3N的电子式为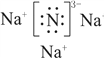 。
。
(2)Na3N与足量盐酸反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl。
(3)Na3N钠离子与氮离子核外都有10个电子,氮的核电荷数较小对核外电子的吸引力较小,所以氮离子半径较大,两种粒子的半径:r(Na+)<r(N3-)。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
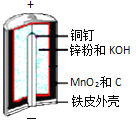
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
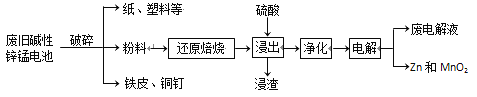
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。