题目内容
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
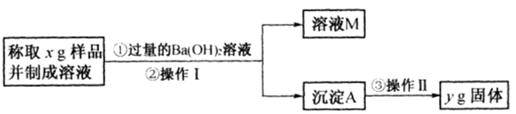
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是 、 。
(2)试剂a最好选用 (供选择使用的有:铝粉、空气、浓HNO3);其作用是 。
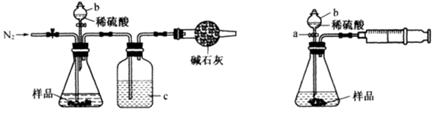
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是 (填序号)。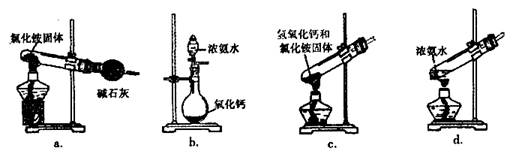
(4)检验溶液Z中含有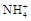 的方法是 。
的方法是 。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。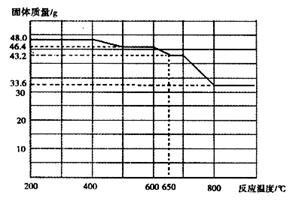
根据图象推断670℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。 。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
(11分)(1)搅拌加速溶解(或搅拌加速反应)(1分)(只答搅拌也得分) 引流(1分)
(2)空气(1分) 作氧化剂,将Fe2+氧化为Fe3+(1分)(答氧化剂、氧化Fe2+或将Fe2+转化为Fe3+也得分)
(3)bd(2分)
(4)取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+。(2分)(三个要点:浓NaOH溶液、湿润的红色石蕊试纸、变蓝。缺一个要点扣1分)
(5)FeO(1分)取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO。(2分)(要点:三组操作与现象、最终结论,少一个扣1分)
解析试题分析:(1)操作Ⅰ是物质的溶解,操作Ⅱ是过滤,都需要用到玻璃棒,玻璃棒在两种操作中的作用分别是,操作Ⅰ是利用玻璃棒加速硫酸渣的溶解,操作Ⅱ中玻璃棒是起到引流作用。
(2)依据流程分析,溶液Y中含有亚铁离子,需要将其氧化成铁离子,因此试剂a主要是用来氧化亚铁离子的。但选择氧化剂不能引入新的杂质,铝粉引入新的杂质,浓硝酸做氧化剂会产生污染气体,最好选择空气做氧化剂氧化亚铁离子,不会引入新的杂质,不污染环境。
(3)a、加热氯化铵分解后生成氨气和氯化氢会在试管口重新生成氯化铵;不能制的氨气,故a不能;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气;故b符合;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,装置中加热会使生成的水倒流到试管底部炸裂试管;故c不选;
d、加热浓氨水会分解生成氨气,可以制取氨气;故d符合,因此答案为bd。
(4)NH4+能和强碱反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝,通过检验氨气的方法来检验NH4+,所以检验溶液Z中含NH4+的实验方法是:取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+。
(5)根据图像可知,加热前氧化铁的物质的量是48g÷160g/mol=0.3mol。加热到670℃时固体质量变为43.2g,即固体质量减少48g-43.2g=4.8g,减少的质量即为氧原子的质量,所以减少的氧原子质量是4.8g÷16g/mol=0.3mol,则根据原子守恒可知,反应后铁原子和氧原子的个数之比是(0.3mol×2):(0.3mol×3-0.3mol)=1:1,所以该固体的化学式是FeO。要检验还原产物,可以通过检验亚铁离子和铁离子的方法来验证,另外还需要排除单质铁,所以正确的操作是取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO。
考点:考查玻璃棒的作用、试剂的选择、氨气的制备和NH4+的检验、氧化铁与CO反应生成物的判断和计算、亚铁离子和铁离子的检验等

为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3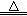 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2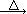 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 | ,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
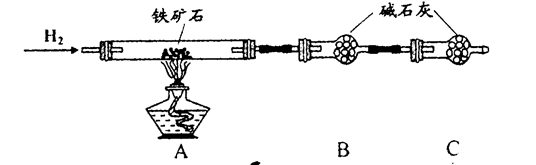
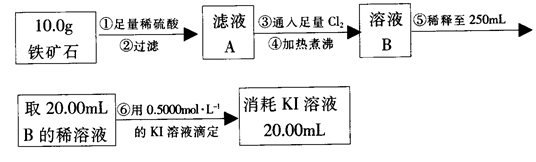
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。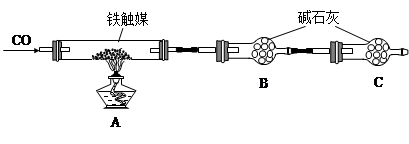
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。
现有等物质的量的铜和银的混合物17.2 g,与50.0 mL的浓硝酸恰好完全反应,产生气体4.48 L(标准状况),则下列说法正确的是
| A.产生的气体是0.2 mol NO2 |
| B.硝酸的物质的量浓度为12 mol·L-1 |
| C.反应中被还原和未被还原的硝酸物质的量之比为3∶2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol |
把3体积的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)
| A.1体积NO | B.2体积NO2和0.5体积O2 |
| C.2体积O2 | D.0.25体积O2 |
下列关于液氯的说法中,不正确的是
| A.液氯属于混合物 | B.液氯呈黄绿色 |
| C.液氯是一种有色、有味、有毒的液体 | D.液氯能使湿润的红色布条褪色 |