题目内容
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:
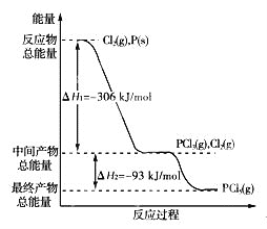
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
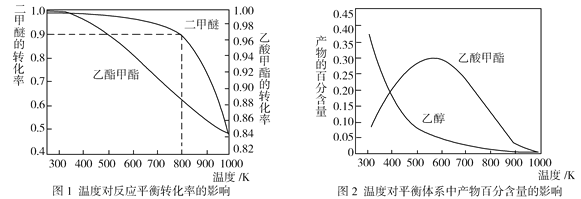
(2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。
(3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
【答案】 2Cu2O(s)+Cu2S(s)![]() 6Cu(s)+SO2(g) ΔH=+116.0kJ/mol 氧化剂 < < 300~600 K范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小 0.225mol·Ll·min1 180
6Cu(s)+SO2(g) ΔH=+116.0kJ/mol 氧化剂 < < 300~600 K范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小 0.225mol·Ll·min1 180
【解析】(1)Cu2S与Cu2O反应生成Cu和SO2的化学方程式为Cu2S+2Cu2O![]() 6Cu+SO2↑,由②×3①,可得2Cu2O(s)+Cu2S(s)
6Cu+SO2↑,由②×3①,可得2Cu2O(s)+Cu2S(s) ![]() 6Cu(s)+SO2(g) ΔH=+116.0 kJ/mol。反应中Cu2S中Cu化合价降低,S元素化合价升高,既是氧化剂又是还原剂,Cu2O中Cu化合价降低,是氧化剂。
6Cu(s)+SO2(g) ΔH=+116.0 kJ/mol。反应中Cu2S中Cu化合价降低,S元素化合价升高,既是氧化剂又是还原剂,Cu2O中Cu化合价降低,是氧化剂。
(2)由图1可知,压强相同,温度升高,二甲醚和乙酸甲酯的平衡转化率均减小,则ΔH1和ΔH2都小于0,即ΔH1<0,ΔH2<0。温度升高,反应①和反应②均逆向移动,但反应②受温度影响更大,逆向移动程度更大,导致乙酸甲酯的百分含量增大,乙醇的百分含量逐渐减小。
(3)由图1可知,压强为p kPa、温度为800 K时,CH3OCH3的平衡转化率为0.9,根据已知条件,列出反应①的三段式: CH3OCH3(g)+CO(g)![]() CH3COOCH3(g)
CH3COOCH3(g)
起始浓度/mol·Ll 0.5 0.5 0
转化浓度/mol·Ll 0.45 0.45 0.45
平衡浓度/mol·Ll 0.05 0.05 0.45
v(CH3COOCH3)=0.45 mol/L÷2 min=0.225mol·Ll·min1;
K=![]() =
=![]() =180。
=180。

【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第________周期______族;
(2)元素Y的原子结构示意图为________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应