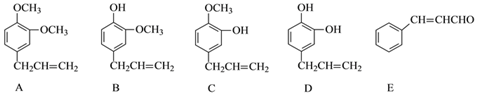
题目内容
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2-8e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
【答案】B
【解析】
A.由电池装置图可知电池工作时,实现了太阳能转化为电能,故正确;B.电子流入的极是正极,所以铜是正极,铜上二氧化碳得到电子生成甲烷,即CO2+8e-+8H+=CH4+2H2O,故错误;C.电池内氢离子透过质子交换膜向正极移动,电子流入的极是正极,所以铜是正极,即电池内氢离子透过质子交换膜从左向右移动,故正确;D.向装置中加入少量强电解质溶液稀硫酸可以增强导电能力,提高该人工光合系统的工作效率,故正确。故选B。

【题目】某化学兴趣小组欲测定 KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,所得数据如图所示。
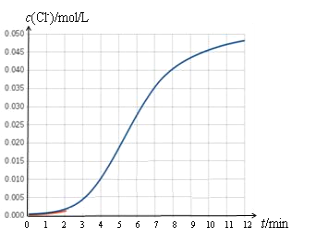
已知:ClO3 + 3HSO3=Cl + 3SO42 + 3H+
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=_________mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步通过测定 c(Cl-)随时间变化的曲线探究影响因素,具体如下表所示。
方案 | 假设 | 实验操作 |
I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
II | 取10mL0.1mol/LKClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液。 | |
III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1mL0.2mol/L 盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液。 |
①补全方案I中的实验操作:_____。
②方案II中的假设为_____。
③除I、II、III中的假设外,还可以提出的假设是_____。
④在已知方案 I 的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_____。
⑤反应后期,化学反应速率变慢的原因是_____。