题目内容
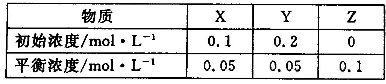
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
| 物质 | X | Y | Z |
| 初始浓度/mol·L- | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L- | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
 2Z,其平衡常数为1600
2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
C
试题分析:反应达到平衡时,X变化的浓度为0.05mol/L,X转化率为0.05/0.1=0.5,A正确;反应中X、Y浓度减少,Z浓度增加,X、Y、Z浓度变化分别为0.05 mol/L、0.15 mol/L、0.1 mol/L,所以化学方程式为X+3Y
 2Z,平衡常数K=
2Z,平衡常数K= 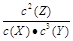 =1600,B正确;增大压强,平衡向右移动,K不变,C错误;平衡常数是温度的函数,D正确。
=1600,B正确;增大压强,平衡向右移动,K不变,C错误;平衡常数是温度的函数,D正确。点评:

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( ) NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( )
Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( ) 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是 B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。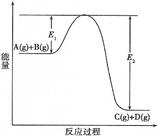
 2Z
2Z