题目内容
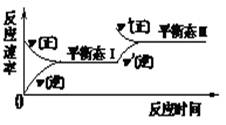
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C.容器②中反应达到平衡时放出的热量为Q=23.15 kJ
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是| 容器编号 | 起始时各物质物质的量(mol) | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q (Q>0) |
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C.容器②中反应达到平衡时放出的热量为Q=23.15 kJ
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
C
试题分析:平衡常数只与温度有关系,A正确;②相当于是1molX2和3molY2,所以二者的平衡状态是等效的,因此根据放出的热量可知,消耗X2的物质的量是23.15 kJ÷92.6 kJ·mol-1=0.25mol,所以生成物的物质的量是0.5mol,则其浓度是0.5mol÷0.25L=2mol/L,B正确;C不正确,放出的热量小于23.15 kJ;增大压强平衡向正反应方向越多,所以放出的热量大于23.15 kJ,D正确,答案选C。
点评:该题的关键是根据起始物质的物质的量判断出二者的平衡是等效的,然后在依据有关条件分析、计算即可。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量 2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( ) 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2AB(g)达到平衡状态的标志是:( )
2AB(g)达到平衡状态的标志是:( ) 2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( )
2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( ) 2SO3(g) 容器内的密度不随时间变化
2SO3(g) 容器内的密度不随时间变化 2C(g)+D(g)容器内气体平均相对分子质量不随时间变化
2C(g)+D(g)容器内气体平均相对分子质量不随时间变化