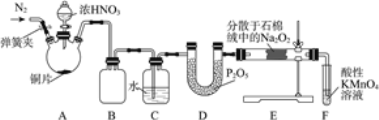题目内容
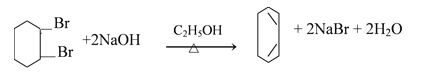
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
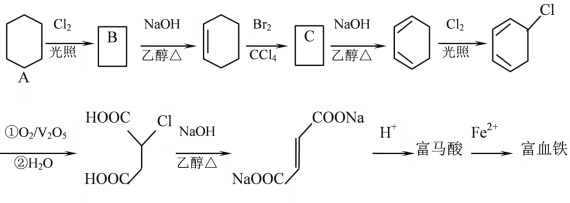
回答下列问题:
(1)A的化学名称为:_________________,由A生成B的反应类型为:___________
(2)C的结构简式为:______________,加热时,C与NaOH的乙醇溶液反应的化学方程式为:___________
(3)富马酸的结构简式为:___________
(4)检验富血铁中是否含有Fe3+的实验操作步骤是:___________
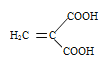
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_______L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有(写出结构简式):___________、___________。
【答案】环己烷 取代反应 
![]() 取少量富血铁,加入稀硫酸溶解,再滴加KSCN溶液,若溶液显血红色,则产品中含有Fe3+;反之,则无 44.8
取少量富血铁,加入稀硫酸溶解,再滴加KSCN溶液,若溶液显血红色,则产品中含有Fe3+;反之,则无 44.8 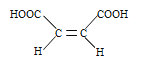
【解析】
环己烷与氯气发生取代反应,生成一氯环己烷,与氢氧化钠醇溶液发生消去反应,生成环己烯,然后与溴的四氯化碳发生加成反应,生成 ,再与氢氧化钠醇溶液发生消去反应,生成1,3-环己二烯,与氯气光照条件下发生取代反应,生成
,再与氢氧化钠醇溶液发生消去反应,生成1,3-环己二烯,与氯气光照条件下发生取代反应,生成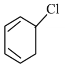 ,然后与氧气在五氧化二钒的催化下发生氧化反应,生成
,然后与氧气在五氧化二钒的催化下发生氧化反应,生成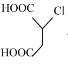 ,再用与氢氧化钠醇溶液发生消去反应后酸化,与亚铁离子结合形成富血铁。
,再用与氢氧化钠醇溶液发生消去反应后酸化,与亚铁离子结合形成富血铁。
(1)A的化学名称为环己烷,由A生成B的反应类型为取代反应;
(2)C的结构简式为 ,加热时,C与NaOH的乙醇溶液发生消去反应,化学方程式为
,加热时,C与NaOH的乙醇溶液发生消去反应,化学方程式为 ;
;
(3)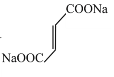 与氢离子结合形成富马酸,即富马酸的结构简式为
与氢离子结合形成富马酸,即富马酸的结构简式为![]() ;
;
(4)检验富血铁中是否含有Fe3+的实验操作步骤是取少量富血铁,加入稀硫酸溶解,再滴加KSCN溶液,若溶液显血红色,则产品中含有Fe3+;反之,则无;
(5)富马酸为二元羧酸,1mol能电离出2mol氢离子,1mol富马酸与足量饱和NaHCO3溶液反应可放出2mol二氧化碳,即44.8L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有(写出结构简式) 、
、 。
。

【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
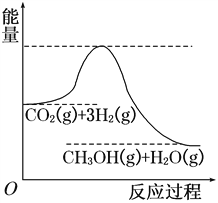
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
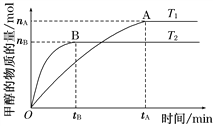
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
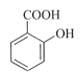 +(CH3CO)2O
+(CH3CO)2O![]()
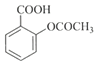 +CH3COOH
+CH3COOH
水杨酸 酸酐 乙酰水杨酸
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~74 | 135~138 |
相对密度/(g/cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中最好采用__________加热(填标号)。
A. 酒精灯 B.热水浴 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号)。
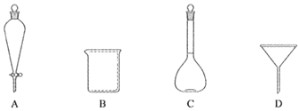
(3)①中需使用冷水,目的是_________________________。
(4)②中的主要化学反应方程式是:____________________。
(5)④采用的纯化方法为____________。
(6)本实验的产率为_________%。