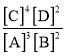题目内容
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题。
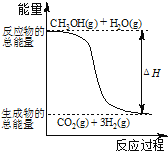
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1,写出CH4还原NO2至N2的热化学方程式:_____。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒镀铜。
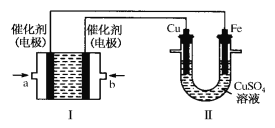
①a处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是 ___________。
②电镀结束后,装置Ⅱ中Cu2+的物质的量浓度____(填写“变大”“变小”或“不变”)。
③若实验过程中Ⅱ中的铜片质量减少了1.28g,则Ⅰ中理论上消耗CH4的体积(标准状况)__ _L。
(3)若将题(2)装置Ⅱ中的两电极均改为石墨惰性电极,电解质溶液仍为CuSO4溶液。
①写出装置Ⅱ中发生的总化学反应方程式_________。
②电解硫酸铜溶液一段时间后,装置Ⅱ中溶液的pH____(填写“变大”“变小”或“不变”);要使原溶液复原,可向电解后的溶液中加入_______。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1 CH4 CH4+10OH--8e-=CO32-+7H2O 不变 0.112L 2CuSO4 + 2H2O![]() 2Cu + O2↑+2H2SO4 变小 CuO或CuCO3
2Cu + O2↑+2H2SO4 变小 CuO或CuCO3
【解析】
(1)根据盖斯定律分析解答;
(2)装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,据此分析解答;
(3)将装置Ⅱ中的两电极均改为石墨惰性电极,电解硫酸铜溶液生成金属铜和硫酸以及氧气,根据总反应方程式分析解答。
(1)CH4还原NO2至N2的化学反应方程式为CH4+2NO2=N2+CO2+2H2O。①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJmol-1,根据盖斯定律,![]() 得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=
得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=![]() ×[(-574kJmol-1)+(-1160kJmol-1)] =-867kJ/mol,故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H=-867kJmol-1;
×[(-574kJmol-1)+(-1160kJmol-1)] =-867kJ/mol,故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H=-867kJmol-1;
(2)装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极。
①Cu作阳极应该连接原电池正极、Fe作阴极连接原电池负极,通入燃料的电极为负极、通入氧气的电极为正极,则a为负极、b为正极,a处通入甲烷、b处通入氧气,a处甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O, 故答案为:CH4;CH4+10OH--8e-=CO32-+7H2O;
②装置Ⅱ中阳极上溶解Cu、阴极上析出Cu,溶解的Cu等于析出的Cu质量,相当于溶液中Cu2+没有参加反应,则铜离子浓度不变,故答案为:不变;
③Ⅱ中的铜片质量减少了1.28g,溶解的铜的物质的量=![]() =0.02mol,失去电子0.04mol;串联电路中转移电子相等,所以消耗甲烷的体积=
=0.02mol,失去电子0.04mol;串联电路中转移电子相等,所以消耗甲烷的体积=![]() ×22.4L/mol=0.112L,故答案为:0.112;
×22.4L/mol=0.112L,故答案为:0.112;
(3)将装置Ⅱ中的两电极均改为石墨惰性电极。
①装置Ⅱ中用惰性电极电解硫酸铜溶液,反应的总化学方程式为:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
②根据电解硫酸铜溶液发生的总化学方程式:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4,反应生成了硫酸,溶液的酸性增强,pH减小;根据出什么加什么、出多少加多少的原理,若想将上述电解后的溶液恢复为与电解前的溶液相同,加入CuO或CuCO3,可以使原溶液复原,故答案为:变小;CuO或 CuCO3。
2Cu+O2↑+2H2SO4,反应生成了硫酸,溶液的酸性增强,pH减小;根据出什么加什么、出多少加多少的原理,若想将上述电解后的溶液恢复为与电解前的溶液相同,加入CuO或CuCO3,可以使原溶液复原,故答案为:变小;CuO或 CuCO3。

【题目】对下列各项叙述的判断及理由正确的是
选项 | 叙述 | 判断及理由 |
A | 糖类和油脂完全燃烧的产物是CO2和水 | 正确.糖类和油脂的组成元素是C、H、O |
B | 一定条件下乙醇、甲烷均能发生取代反应 | 错误.乙醇不能发生取代反应 |
C | 淀粉和纤维素是同分异构体 | 正确.淀粉和纤维素的化学式均为(C6H10O5)n |
D | 若乙烯中混有SO2气体,可通过酸性高锰酸钾溶液除去 | 正确.酸性条件下SO2可被高锰酸钾氧化 |
A.AB.BC.CD.D