题目内容
11.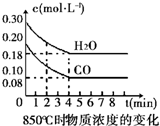 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K=1.0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).
分析 (1)根据图象可知平衡时各物质的浓度,利用平衡常数的定义计算,平衡常数等于生成物平衡你的幂次方乘积除以反应物平衡你的幂次方乘积,降低温度平衡向放热反应进行,反应速率减小,根据影响平衡常数及反应速率的因素判断;
(2)①在3min~4min之间各物质的浓度不变,反应处于平衡状态,由于该反应为放热反应,升高温度平衡逆向移动,据此判断;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,据此判断;
(3)计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向,据此解答.
解答 解:(1))可逆反应达到平衡状态各物质的浓度依据图象分析可知
CO(g)十H2O(g)?CO2(g)十H2 (g)
起始量(mol/L) 0.20 0.30 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.18 0.12 0.12
反应的平衡常数k=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.18}$=1,
根据图象可知,0~4min的平均反应速率v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/L•min,
平衡常数只受温度的影响,反应是放热反应,若降低温度,平衡正向进行,该反应的K值将增大,反应的化学反应速率将减小,
故答案为:1;0.03;增大;减小;
(2)①由表中数据可知,3min、4min时对应各组分的浓度相同,故处于平衡状态;在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选d,
故答案为;d;
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,
CO(g)+H2O(g)═CO2(g)+H2 (g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 0.5
一段时间(mol/L):0.5 1.5 0.5 0.5
浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆),
故答案为:否;大于,浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).
点评 本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等,(2)中注意分析各物质的浓度变化量关系,确定平衡改变的条件.

| A. | 常温常压下,1molCO2与18gH2O所含有的原子总数均为3NA | |
| B. | 20℃时,1molSO2的体积一定大于22.4L | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
| A. | 氧化性:浓硝酸大于稀硝酸 | |
| B. | 与相同质量的铜(反应完全)反应中转移的电子总数相同 | |
| C. | 与锌反应:前者生成NO2,后者生成H2 | |
| D. | 与铜反应:前者生成气体颜色深,后者生成气体颜色浅 |
| A. | 乙醇不能发生取代反应 | |
| B. | C4H10有三种同分异构体 | |
| C. | 乙二醇和丙三醇为同系物 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| A. | 常温下,32gO2含有2nA个氧原子 | |
| B. | 1mol Na2O2与足量水反应,转移2nA个电子 | |
| C. | 1L0.1mol•L-1Na2CO3溶液中含有0.1nA个CO${\;}_{3}^{2-}$ | |
| D. | 常温常压下,22.4LCH4中含有nA个CH4分子 |
| A. | NaOH | B. | NaCl | C. | H2SO4 | D. | 盐酸 |
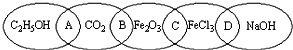 如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: .
.