题目内容
1.设NA代表阿伏加德罗常数,下列叙述正确的是( )| A. | 常温常压下,1molCO2与18gH2O所含有的原子总数均为3NA | |
| B. | 20℃时,1molSO2的体积一定大于22.4L | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
分析 A、1mol二氧化碳中含3mol原子,然后求出水的物质的量,根据水中含3个原子来分析;
B、二氧化硫所处的压强不明确;
C、1mol/L是指在1L的溶液中含有溶质1mol;
D、一氧化氮与氧气混合会发生反应生成二氧化氮,所以混合后气体的物质的量减小,分子数目减小.
解答 解:A、18g水的物质的量为1mol,而 CO2与 H2O均为3原子分子,故1mol二氧化碳和水中均含3mol原子即3NA个,故A正确;
B、压强不明确,故气体摩尔体积的数值不明确,则1mol二氧化硫的体积不能计算,故B错误;
C、1mol/LNaCl溶液表示1L溶液中含有氯化钠1mol,即58.5g,故C错误;
D、标准状况下,11.2L气体的物质的量为0.5mol,0.5mol一氧化氮与0.25mol氧气混合,生成的0.5mol二氧化氮中存在平衡:2NO2?N2O4,所以混合后的气体物质的量小于0.5mol,所含分子数小于0.5NA,故D错误,
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列物质中一定属于同系物的是( )
| A. | C4H10和C5H12 | B. | C2H6和C3H6 | C. | C2H2和C4H6 | D. | C3H6和C4H8 |
12.蓄电池放电时是起原电池的作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电、放电时的反应:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2,下列有关爱迪生电池的各种推断中错误的是( )
| A. | 放电时铁做负极,NiO2做正极 | |
| B. | 充电时阴极上的电极反应为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 放电时,电解质溶液中的阴离子是向正极方向移动 | |
| D. | 蓄电池的两个电极必须浸入在碱性溶液中 |
9.最近科学家用巨型计算机进行模拟后确认,由60个N原子可结合成N60分子,N60变成N2时放出巨大能量.下列有关N60的说法不正确的是( )
| A. | N60与N2是同素异形体 | B. | N60一定是比N2更稳定的分子 | ||
| C. | N60的相对分子质量为840 | D. | N60可能是一种很好的火箭燃料 |
6.下列说法中正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流入的一极是正极,发生还原反应 | |
| C. | 铜锌原电池中电子由锌电极经过溶液到铜电极 | |
| D. | 原电池中的阳离子向负极移动 |
13.科学家最近发现一种新微粒O4,有关这种新微粒的说法正确的是( )
| A. | 它的结构与P4相同 | |
| B. | 它的摩尔质量为64 | |
| C. | 它是氧气的同素异形体 | |
| D. | 它是由两个氧分子通过分子间作用力结合而成的新微粒 |
10.下列说法错误的是( )
| A. | 已知反应2A(g)+B(g)?3C(g)△H>0,若温度降低,逆反应速率减小 | |
| B. | 在恒容容器中发生反应N2(g)+3H2(g)?2NH3(g),若往容器中充入He,正逆反应的速率均不变 | |
| C. | 当一定量的锌粉和4 mol•L-1的过量盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向容器中加入一些水或硝酸钠溶液 | |
| D. | 对任何一个化学反应,温度发生变化,化学反应速率一定发生变化 |
11.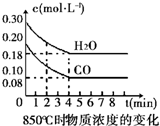 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K=1.0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态; c1数值大于0.08mol•L-1 (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K=1.0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).