题目内容
1.试回答下列问题:(1)标准状况下11.2L NH3中含3.01×1023个氨分子,1.5mol氢原子;
(2)等质量的SO2和SO3所含的原子个数之比是15:16,物质的量之比是5:4;
(3)6.8gNH3中所含氢原子数与10.8g水所含氢原子数相等.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,根据N=nNA计算氨气分子数目,氢原子物质的量为氨气分子的3倍;
(2)根据n=$\frac{m}{M}$计算二者物质的量之比,再结合分子式计算所含原子个数之比;
(3)根据n=$\frac{m}{M}$计算氨气的物质的量,根据H原子数目相等计算水的物质的量,再根据m=nM计算水的质量.
解答 解:(1)氨气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氨气分子数目为0.5mol×6.02×1023mol-1=3.01×1023,氢原子物质的量为0.5mol×3=1.5mol,故答案为:3.01×1023;1.5;
(2)根据n=$\frac{m}{M}$可知等质量的SO2和SO3物质的量之比是80g/mol:64g/mol=5:4,所含的原子个数之比是5×3:4×4=15:16,故答案为:15:16;5:4;
(3)6.8g氨气的物质的量为$\frac{6.8g}{17g/mol}$=0.4mol,与之含有H原子数目相等水的物质的量为$\frac{0.4mol×3}{2}$=0.6ml,则水的质量为0.6mol×18g/mol=10.8g,
故答案为:10.8.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
11.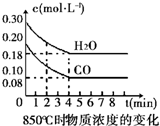 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K=1.0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态; c1数值大于0.08mol•L-1 (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K=1.0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min间,平衡向逆方向移动,可能的原因是d
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$<1,故平衡向正反应进行,此时v(正)>v(逆).
12.下列说法错误的是( )
| A. | 用稀硫酸可除去钢铁表面的铁锈 | |
| B. | 使用焰色反应可检验氯化钠中的钠离子 | |
| C. | 通过丁达尔效应可区分NaCl溶液和Al(OH)3胶体 | |
| D. | 向溶液中滴入硝酸银溶液产生白色沉淀,可证明含有Cl- |
6.下列说法中错误的是( )
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同 | |
| D. | 短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b |
13.有Fe、CuO和Fe2O3组成的混合物共mg,放人500mL1mol•L-1 HNO3溶液中,混合物完全溶解,生成2.24L(标准状况下)NO,再向反应后的溶液中加入200mL NaOH溶液,要使铁和铜元素完全沉淀下来,所加入的NaOH溶液的浓度最小是( )
| A. | 1mol•L-1 | B. | 1.5mol•L-1 | C. | 2mol•L-1 | D. | 2.5mol•L-1 |


 2SO3.
2SO3.