题目内容
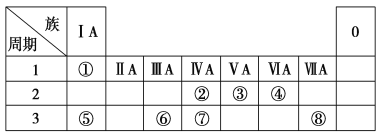
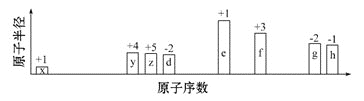
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在周期表中的位置是____________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:__________________。
(4)写出e的单质在足量d2中燃烧后的产物与y的高价氧化物反应的化学方程式:______。
(5)写出由x、y、z、d四种元素构成的离子化合物的化学式(写一种)___________。
【答案】第三周期ⅢA族 r(O2)> r(Na+) HClO4 H2SO4 ![]() (或
(或![]()
![]() ) 2Na2O2+2CO2==2Na2CO3+O2 (NH4)2CO3或NH4HCO3
) 2Na2O2+2CO2==2Na2CO3+O2 (NH4)2CO3或NH4HCO3
【解析】
从图表信息可知,八种元素均为短周期,结合最高正价或最低负价变化规律可知,x为H; y为C;z为N;d为O; e为Na;f 为Al;g为S;h为Cl;据以上分析解答。
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,故答案为:第三周期ⅢA族;
故答案是:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4;
故答案为:r(O2)>r(Na+);HClO4;H2SO4;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为:![]() (或
(或![]()
![]() ),
),
故答案为:![]() (或
(或![]()
![]() );
);
(4)钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式:2Na2O2+2CO2==2Na2CO3+O2;
故答案为:2Na2O2+2CO2==2Na2CO3+O2;
(5)由x、y、z、d四种元素构成的离子化合物的化学式可以是(NH4)2CO3或NH4HCO3;
故答案为:(NH4)2CO3或NH4HCO3。

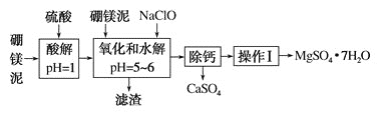
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。