题目内容
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
【答案】D
【解析】甲烷的燃烧热是生成液态水时放出的热量,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故A错误;合成氨反应可逆,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)的物质的量小于1mol,故B错误;中和热是稀强酸、稀强碱反应,生成1mol水放出的热量,H2SO4和Ca(OH)2反应的中和热是ΔH=-57.3kJ·mol-1,故C错误;相同物质的量的碳完全燃烧生成二氧化碳放出的热大于生成CO放出的热,故D正确。

 名校课堂系列答案
名校课堂系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验. 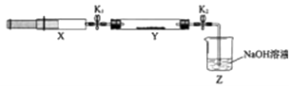
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |
