题目内容
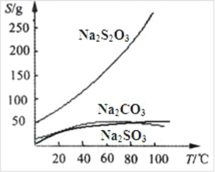
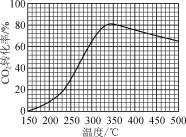
【题目】恒压下,将CO2和H2以体积比1∶4混合进行反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
A.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH>0
B.图中450 ℃时,延长反应时间无法提高CO2的转化率
C.350 ℃时,c(H2)起始=0.4 mol·L-1,CO2平衡转化率为80%,则平衡常数K<2 500
D.当温度从400 ℃升高至500 ℃,反应处于平衡状态时,v(400℃)逆>v(500℃)逆
【答案】BC
【解析】
如图所示为用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况,约350℃之前,反应还未达到平衡态,CO2转化率随温度升高而增大,约350℃之后,反应达到化学平衡态,CO2转化率随温度升高而减小,由此可知该反应为放热反应。
A.由分析可知该反应为放热反应,则ΔH<0,故A错误;
B.图中450 ℃时,反应已达平衡态,则延长反应时间无法提高CO2的转化率,故B正确;
C.350 ℃时,设起始时容器的容积为V,c(H2)起始=0.4 mol·L-1,则n(H2)起始=0.4 Vmol,CO2平衡转化率为80%,可列三段式为:
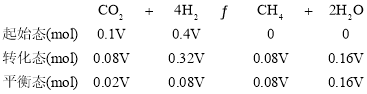
根据阿伏伽德罗定律有![]() ,平衡时的体积为V(平衡)=
,平衡时的体积为V(平衡)= ![]() ,则平衡时
,则平衡时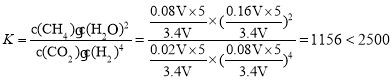 ,故C正确;
,故C正确;
D.温度升高,正逆反应速率均加快,则v(400℃)逆<v(500℃)逆,故D错误;
综上所述,答案为BC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目