题目内容
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O 于 40~45℃熔化,48℃分解;
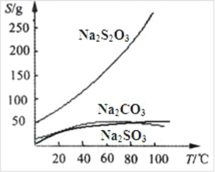
Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
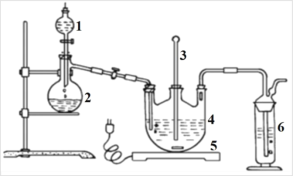
Ⅰ.现按如下方法制备Na2S2O3·5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为_____________,装置6中可放入_____________。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2 ② Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通入SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O 并测定含量:

(3)从热的反应混合液中获得 Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→________→________→________→________→获得Na2S2O3·5H2O粗晶体。
a.用冰水浴冷却结晶,抽滤; b.用少量水洗涤晶体、烘干;
c.80℃蒸发浓缩滤液至溶液表面出现晶膜; d.用乙醇洗涤晶体、晾干;
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊; f.趁热过滤。
(4)制得的粗晶体中往往含有少量杂质。为了测定粗产品中 Na2S2O3·5H2O的含量, 一般采用在酸性条件下用 KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.280 g的粗样品溶于水,用 0.4000 mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗 KMnO4溶液体积20.00 mL。 试回答:
①对于上述实验操作,下列说法正确的是_____。
A.用电子天平称量粗样品时,若电子天平未进行调平,则纯度偏高
B.装 KMnO4标准液的酸式滴定管洗涤后若未润洗,则纯度偏高
C.滴定至锥形瓶内溶液刚好由无色变为浅红色立即进行读数,则纯度偏高
D.滴定时若滴定速度过慢或摇晃锥形瓶过于剧烈,则纯度偏高
②产品中Na2S2O3·5H2O的质量分数为_____________。
【答案】蒸馏烧瓶 CD Na2S2O3在酸性环境中不能稳定存在,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O f e a d B 96.9%
【解析】
I.在蒸馏烧瓶中浓硫酸和亚硫酸钠反应生成二氧化硫,在三颈烧瓶中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,Na2S2O3在酸性环境中不稳定,容易分解得到S与二氧化硫,二氧化硫不易过量,碳酸钠可以反应掉氢离子,防止溶液呈酸性,尾气中有未反应的二氧化硫,在装置⑥中用氢氧化钠溶液、酸性高锰酸钾溶液等吸收;
II.(3)根据流程图,及Na2S2O3·5H2O于 40~45℃熔化,48℃分解,分析判断操作步骤的先后顺序;
(4)①根据滴定消耗标准溶液的体积大小判断实验误差;
②根据n=cV计算出样品消耗的高锰酸钾的物质的量,根据反应计算出样品中含有Na2S2O35H2O的物质的量,进而计算出产品中Na2S2O35H2O的质量分数。
I. (1)仪器2的名称为蒸馏烧瓶;装置6吸收未反应的SO2,防止污染空气,SO2具有还原性,可以被酸性KMnO4溶液氧化;SO2是酸性氧化物,能与NaOH溶液反应,不能被BaCl2溶液、浓H2SO4吸收,故合理选项是CD;
(2)当溶液pH<7时,溶液显示酸性,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O,所以Na2S2O3在酸性环境中不能稳定存在,应该使溶液的pH不小于7,
Ⅱ.(3)热的反应混合液→活性炭脱色并保温→常温下溶液中析出晶体为Na2S2O35H2O,为了避免析出Na2S2O35H2O导致产率降低,所以要趁热过滤,Na2S2O35H2O于40~45℃熔化,48℃分解,所以蒸发时温度过高会导致析出的晶体分解,降低了产率,应该45℃蒸发浓缩滤液至溶液呈微黄色浑浊,再用冰水浴冷却结晶,抽滤;结合Na2S2O3易溶于水,不溶于乙醇的性质最后选择乙醇洗涤,且洗涤后乙醇易挥发,不引入新的杂质, 故操作先后顺序用字母表示为:f、e、a、d;
(4)①A. 用电子天平称量粗样品时,若电子天平未进行调平,则样品质量偏大,而含有的Na2S2O35H2O质量不变,最后导致测定的物质纯度偏低,A错误;
B. 装KMnO4标准液的酸式滴定管洗涤后若未润洗,会使标准溶液被稀释而浓度降低,消耗标准溶液体积偏大,以此为标准计算的Na2S2O35H2O含量偏多,使物质纯度偏高,B正确;
C. 滴定至锥形瓶内溶液刚好由无色变为浅红色立即进行读数,消耗标准溶液体积偏少,计算的Na2S2O35H2O的质量就偏少,则物质纯度偏低,C错误;
D. 滴定时若滴定速度过慢会使样品被氧化或摇晃锥形瓶过于剧烈,导致溶液逸出,会使消耗标准溶液体积偏少,以此为标准计算的物质纯度偏低,D错误;
故合理选项是B;
②20.00 mL 0.4000 mol/LKMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.4000 mol/L×0.02 L=0.0080 mol,根据反应:5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O,可知1.280 g的粗样品含有Na2S2O35H2O的物质的量为:n(Na2S2O35H2O)=n(S2O32-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.0080 mol=0.0050 mol,产品中Na2S2O35H2O的质量分数为:
×0.0080 mol=0.0050 mol,产品中Na2S2O35H2O的质量分数为:![]() ×100%=96.9%。
×100%=96.9%。

【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=____。
②若TK时,化学平衡常数K=15,则10s时v(正)___v(逆)(填“>”“<”或“=”),此时CO2的转化率为____。
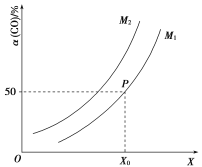
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和ymolH2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。

【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出).
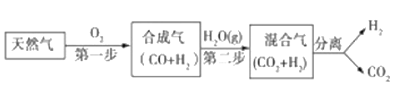
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),某温度下,将1mol CO2和3mol H2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0. 90 | 0. 85 | 0. 83 | 0. 81 | 0. 80 | 0. 80 |
①用H2表示前2h平均反应速率v(H2)=___.
②该温度下CO2的平衡转化率为___.
(2)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1:3通入一恒压密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
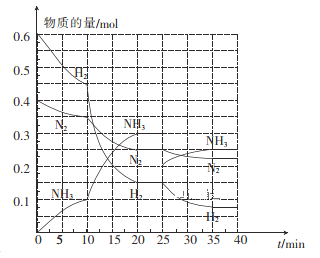
①在10~20 min内,NH3浓度变化的原因可能是_______。
A. 加入催化剂 B. 缩小容器体积 C. 降低温度 D. 增加NH3的物质的量
② 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)