题目内容
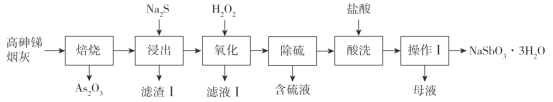
【题目】焦锑酸钠(NaSbO3·3H2O)可用于搪瓷的乳白剂及铁皮、钢板的抗酸漆。一种利用高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物)生产焦锑酸钠的工艺流程如下:
已知:i.Sb2O3、As2O3部分性质如下表:
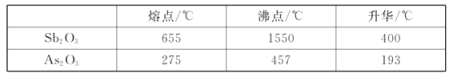
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为_________(填标号)
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是_________________________________________。“浸出”时,Sb2O3转化为Na3SbS3的化学方程式为__________________________________________,滤渣Ⅰ是____________。
(3)“氧化”时所用H2O2的电子式为___________,氧化产物为Na3SbO4和____________.
(4)“酸洗”的作用是______________________。(用化学方程式表示)
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:

已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用______________方法除去该废水中的砷,除去砷后的废液中c(AsO43-)=__________________(不考虑反应过程中溶液体积的微小变化)
【答案】d 提高浸出速率 Sb2O3+6Na2S+3H2O=2Na3SbS3+6NaOH Ag、Cu、Fe的氧化物 ![]() S Na3SbO4+2HCl+2H2O=NaSbO3·3H2O+2NaCl 氧化 4.75×10-19mol·L-l
S Na3SbO4+2HCl+2H2O=NaSbO3·3H2O+2NaCl 氧化 4.75×10-19mol·L-l
【解析】
高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物),焙烧,As2O3因升华而分离出;加入硫化钠溶液,将Ag、Cu、Fe的氧化物除去,Sb2O3转化为Na3SbS3,反应为:Sb2O3+6Na2S+3H2O=Na3SbS3+6NaOH;加入过氧化氢,可将Na3SbS3氧化生成Na3SbO4和S,过滤得到Na3SbO4和S的混合物,然后进行除硫,过滤得到Na3SbO4,加入盐酸,可生成NaSbO33H2O,过滤得到NaSbO33H2O,以此解答该题。
(1)焙烧的目的是使As2O3升华,根据题目信息可知193℃时,As2O3升华,所以选d;
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是增大浸出速率,提高Sb的浸出率;“浸出”时,Sb2O3转化为Na3SbS3,根据各元素的化合价可知该过程不是氧化还原反应,硫化钠溶液显碱性,再根据元素守恒可得化学方程式为:Sb2O3+6Na2S+3H2O=Na3SbS3+6NaOH;Ag、Cu、Fe的氧化物不溶于Na2S溶液,故滤渣I为Ag、Cu、Fe的氧化物;
(3)H2O2的电子式为:![]() ;过氧化氢具有氧化性,可将Na3SbS3中的Sb元素和S元素氧化生成Na3SbO4和S;
;过氧化氢具有氧化性,可将Na3SbS3中的Sb元素和S元素氧化生成Na3SbO4和S;
(4)由流程可知,“酸洗”得到产品NaSbO3·3H2O沉淀,没有元素化合价发生变化,根据元素守恒可得反应方程式为:Na3SbO4+2HCl+3H2O=NaSbO3·3H2O+2NaCl;
(5)根据题目信息可知FeAsO4更容易沉淀,H3AsO3的还原性比Fe2+强,可加入适当的氧化剂将其中H3AsO3和Fe2+氧化得到FeAsO4沉淀;已知:Ksp(FeAsO4)=5.70×10-21,H3AsO3为0.378g/L,则c(H3AsO3)=![]() =0.003mol/L,同理c(Fe3+)= c(Fe2+)=
=0.003mol/L,同理c(Fe3+)= c(Fe2+)=![]() =0.015mol/L,所以加入足量氧化剂后,H3AsO3转化为FeAsO4沉淀,Fe3+剩余,则除去砷后的废液中c(AsO43-)=
=0.015mol/L,所以加入足量氧化剂后,H3AsO3转化为FeAsO4沉淀,Fe3+剩余,则除去砷后的废液中c(AsO43-)=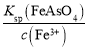 =
=![]() mol/L=4.75×10-19mol/L。
mol/L=4.75×10-19mol/L。