题目内容
3.下列实验装置及目的中,正确的是( )| A | B | C | D | |
| 装置图 | 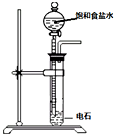 | 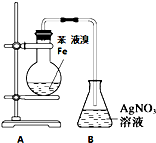 | 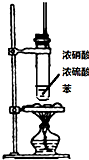 | 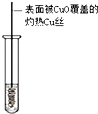 |
| 实验目的 | 乙炔的制备 | AgNO3验证苯与液溴发生取代反应 | 制备硝基苯 | 验证乙醇的还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生成的氢氧化钙易堵塞分液漏斗;
B.挥发的溴也能和硝酸银反应生成淡黄色沉淀;
C.制取硝基苯应该用水浴加热;
D.乙醇和氧化铜发生氧化反应生成乙醛和Cu.
解答 解:A.生成的氢氧化钙易堵塞分液漏斗,所以分液漏斗不能伸入液面下,故A错误;
B.挥发的溴也能和硝酸银反应生成淡黄色沉淀,所以应该先除去HBr中含有的溴,故B错误;
C.制取硝基苯时温度为55~60℃,应该用水浴加热,不能直接加热,故C错误;
D.乙醇和氧化铜发生氧化反应生成乙醛和Cu,所以能检验乙醇的还原性,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及硝基苯的制取、物质检验、基本操作等知识点,明确实验原理是解本题关键,能从实验操作规范性、操作评价性分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列金属氧化物均可由铝热反应制取相应的金属,其中金属化合价最低为( )
| A. | MnO2 | B. | WO3 | C. | Cr2O3 | D. | Co3O4 |
11.鼠尾草酚用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

| A. | X、Y、Z属于芳香族化合物 | |
| B. | X、Y、Z均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol X或1mol Z与NaOH溶液反应,均最多消耗3molNaOH | |
| D. | X、Y、Z均能与溴的四氯化碳溶液发生加成反应 |
18.类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论.因此,推出的结论最终要经过实践的检验才能决定其是否正确.以下几种类推结论中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | Fe3O4可以写成FeO•Fe2O3;Pb3O4也可以写成PbO•Pb2O3 | |
| D. | NaHSO4与NaHSO3溶于水显酸性,则所有酸式盐溶于水显酸性 |
8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
15.图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
| A. | 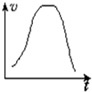 此图表示一定条件下某化学反应速率随时间变化趋势图,该反应不可能为吸热反应 | |
| B. | 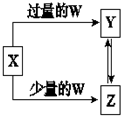 此图中X可以是H2S,W可以是O2 | |
| C. | 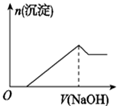 此图表示向AlCl3、MgCl2的混合液中逐滴滴入NaOH至过量 | |
| D. | 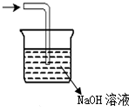 此图可以用来直接处理像H2S、Cl2、NO等尾气 |
12.下列有关生活中的化学,说法不正确的是( )
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火 |
 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.