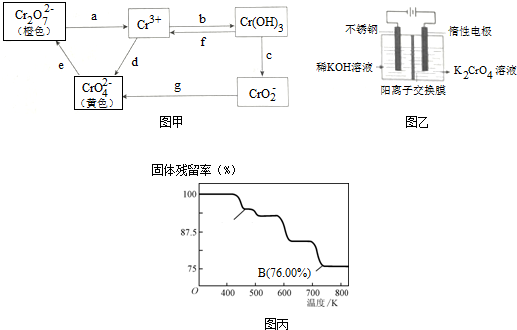
题目内容
13.在200mL 0.1mol/L的硫酸溶液中,分别加入相同体积0.2mol/L的NaOH溶液和氨水,反应后溶液对石蕊试液显色分别是紫色、红色.分析 200mL 0.1mol/L的硫酸溶液中,分别加入相同体积0.2mol/L的NaOH溶液和氨水,则酸碱恰好完全反应,生成硫酸钠溶液和硫酸铵溶液,根据离子的水解原理以及溶液的酸碱性来回答.
解答 解:200mL 0.1mol/L的硫酸溶液中,分别加入相同体积0.2mol/L的NaOH溶液和氨水,则酸碱恰好完全反应,生成硫酸钠溶液和硫酸铵溶液,硫酸钠溶液现实中性,石蕊试液不变色,硫酸铵中铵根离子水解显示酸性,石蕊试液显示红色,故答案为:紫色、红色.
点评 本题考查学生盐的水解原理以及溶液酸碱性的判断知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
4. 对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
 对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )| A. | 增大N2的浓度 | B. | 升高温度 | C. | 增大压强 | D. | 增大NH3的浓度 |
9.下列离子方程式中不正确的是( )
| A. | 将盐酸加入稀氨水中 H++NH3•H2O═NH4++H2O | |
| B. | 以酚酞为指示剂用标准盐酸滴定苏打溶液CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铝溶液与氢氧化钠溶液混合后,铝元素有一半转化为偏铝酸钠2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| D. | 用氯气与石灰浆生产漂白粉 Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
6.下列有关实验仪器的使用方法及实验操作正确的是( )
| A. | 蓝矾结晶水测定实验中,用坩埚钳取下坩埚放置在桌面上冷却 | |
| B. | 用试管夹夹持试管加热时,用手紧紧握住试管夹的长柄和短柄 | |
| C. | 测定中和反应的反应热时,将NaOH溶液一次性倒入盐酸中,并用环形玻璃搅拌棒搅动溶液 | |
| D. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取→蒸馏 |
7.已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈蓝色.据此判断下列说法正确的是( )
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 |
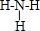 ,D2C含有的化学键类型为离子键;
,D2C含有的化学键类型为离子键; ;
;