题目内容
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大。
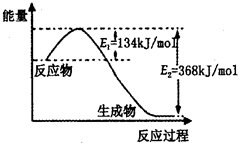
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+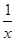 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+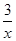 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。
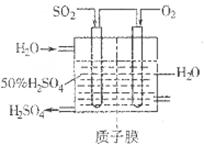
写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g) 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
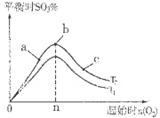
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g) 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
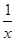 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol2COS(g)+SO2(g)=2CO2(g)+
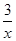 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。

写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g)
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)
 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
(1)CO(g)+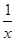 Sx(s)=COS(g) △H=
Sx(s)=COS(g) △H=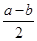 kJ/mol(2分)
kJ/mol(2分)
(2)SO2-2e-+2H2O=SO42-+4H+(2分)
(3)①0.2mol·L-1·min-1(2分,无单位或单位错误不得分) ②b d(2分)③c(2分) >(2分)
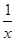 Sx(s)=COS(g) △H=
Sx(s)=COS(g) △H=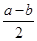 kJ/mol(2分)
kJ/mol(2分)(2)SO2-2e-+2H2O=SO42-+4H+(2分)
(3)①0.2mol·L-1·min-1(2分,无单位或单位错误不得分) ②b d(2分)③c(2分) >(2分)
试题分析:(1)根据已知反应①SO2(g)+2CO(g)=2CO2(g)+
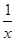 Sx(s) △H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+
Sx(s) △H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+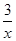 Sx(s) △H=bkJ/mol,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+
Sx(s) △H=bkJ/mol,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+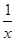 Sx(s)=COS(g),所以该的反应热△H=
Sx(s)=COS(g),所以该的反应热△H=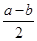 kJ/mol。
kJ/mol。(2)该装置是原电池,氧气得到电子,在正极通入。SO2失去电子,在负极通入。原电池中阴离子向正极移动,由于存在质子交换膜,因此氢离子在负极生成,所以SO2电极的电极反应式为SO2-2e-+2H2O=SO42-+4H+。
(3)①5 min后反应达到平衡,二氧化硫的转化率为50%,则反应中消耗SO2的物质的量是4mol×50=2mol,其浓度是2mol÷2L=1mol/L,所以前5 min内SO2的平均反应速率=
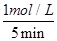 =0.2mol/( L·min)。
=0.2mol/( L·min)。②a.温度和容器体积不变,充入1.0molHe (g),物质的浓度不变,平衡不移动,所以a不正确;b、温度和容器体积不变,充入2molSO2和lmolO2,则相当于是增大压强,平衡向正反应方向移动,所以SO2的转化率及SO3的平衡浓度都比原来增大,b正确;c、温度和容器体积不变,充入1.0molSO2,平衡向正反应方向移动,三氧化硫的浓度增大,但SO2的转化率降低,c不正确;d、在其他条件不变时,减小容器的容积,压强增大,平衡向正反应方向移动,所以SO2的转化率及SO3的平衡浓度都比原来增大,d正确,答案选bd。
③根据图像可知,b点时三氧化硫的含量最高,继续增大氧气的浓度平衡向正反应方向移动,SO2的转化率增大,所以在a、b、c三点所处的平衡状态中,SO2的转化率最高的是c点。由于该反应是放热反应,升高温度平衡向逆反应方向移动,三氧化硫的含量降低。根据图像可知,在氧气的物质的量相同的情况下,T2曲线表示的三氧化硫含量高,因此温度是T1>T2。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 始终保持增大
始终保持增大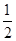 O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。
O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。 O2(g)ΔH=242 kJ·mol-1
O2(g)ΔH=242 kJ·mol-1
 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol H= -Q1 kJ/mol;
H= -Q1 kJ/mol;  2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,

 CH3OH(g) ΔH1
CH3OH(g) ΔH1