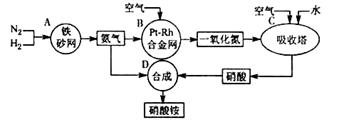
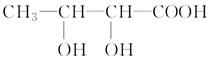题目内容
根据以下三个热化学反应方程式:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l) 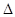 H= -Q1 kJ/mol;
H= -Q1 kJ/mol;
2H2S(g)+O2(g) =2S(s) +2H2O(l)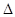 H= -Q2kJ/mol;
H= -Q2kJ/mol;
2H2S(g)+O2(g) =2S(s)+2H2O(g)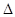 H= -Q3kJ/mol。
H= -Q3kJ/mol。
判断Q1、Q2、Q3三者关系正确的是
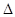 H= -Q1 kJ/mol;
H= -Q1 kJ/mol; 2H2S(g)+O2(g) =2S(s) +2H2O(l)
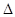 H= -Q2kJ/mol;
H= -Q2kJ/mol;2H2S(g)+O2(g) =2S(s)+2H2O(g)
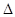 H= -Q3kJ/mol。
H= -Q3kJ/mol。判断Q1、Q2、Q3三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
A
试题分析:已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1 kJ/mol,
②2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2 kJ/mol,
③2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=-Q3kJ/mol,
①与②相比较,由于S→SO2放热,则Q1>Q2,
②与③相比较,由于H2O(l)→H2O(g)吸热,则Q2>Q3,则Q1>Q2>Q3,故选A.

练习册系列答案
相关题目
 O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol
O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol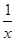 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol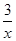 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。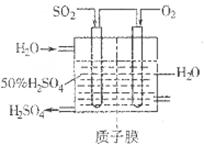
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究: 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。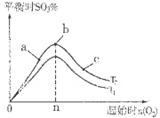
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。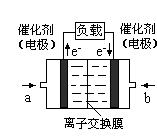
 CH3OH(g) △H
CH3OH(g) △H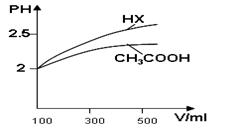

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。