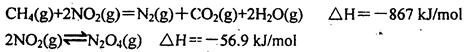��Ŀ����
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���

��ӦI�� CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ��H2
CH3OH(g)+ H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� (�I����)��
���������������������£������¶ȶԷ�ӦII��Ӱ�죬ʵ������ͼ��ʾ
��ͼ�������ж� ��H2 0 (���������=������)��
��ij�¶��£���2 mol CO2��6 mol H2����2L���ܱ������У�������ӦII���ﵽƽ����c(CO2)= 0��2 mol/L�� ���ʱ�����е�ѹǿΪԭ���� ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H =-1275��6 kJ/mol
�� 2CO (g)+ O2(g) = 2CO2(g) ��H =-566��0 kJ/mol
�� H2O(g) = H2O(l) ��H =-44��0 kJ/mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�

�ٸõ�ظ����ĵ缫��ӦΪ
�ڴ˵�����ļ״�1��6��ʱ����Ӧ�е���ת����ĿΪ
�����Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������ص� (��������)
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���

��ӦI�� CO(g)+2H2(g)
 CH3OH(g) ��H1
CH3OH(g) ��H1��ӦII�� CO2(g)+3H2(g)
 CH3OH(g)+ H2O(g) ��H2
CH3OH(g)+ H2O(g) ��H2��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� (�I����)��
���������������������£������¶ȶԷ�ӦII��Ӱ�죬ʵ������ͼ��ʾ
��ͼ�������ж� ��H2 0 (���������=������)��
��ij�¶��£���2 mol CO2��6 mol H2����2L���ܱ������У�������ӦII���ﵽƽ����c(CO2)= 0��2 mol/L�� ���ʱ�����е�ѹǿΪԭ���� ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H =-1275��6 kJ/mol
�� 2CO (g)+ O2(g) = 2CO2(g) ��H =-566��0 kJ/mol
�� H2O(g) = H2O(l) ��H =-44��0 kJ/mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�

�ٸõ�ظ����ĵ缫��ӦΪ
�ڴ˵�����ļ״�1��6��ʱ����Ӧ�е���ת����ĿΪ
�����Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������ص� (��������)
��1�� �� I �� < �� 0��6 ��2��442��8 KJ ��3��CH3OH+8OH- -6e- = CO32- +6H2O0��3NA ����
�����������1��ԭ�Ӿ��þ��Ƿ�Ӧ���ԭ��ȫ��ת��Ϊ�����ѡ��ӦI�Ļ��Ϸ�Ӧ����ͼ��֪��T2>T1�������¶ȼ״������ʵ������٣�˵�������¶Ȼ�ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ������淴Ӧ���������ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H2<0���۷�Ӧ��ʼʱC��CO2��="1mol/L," C(H2)=3mol/L���ڴﵽƽ����c(CO2)= 0��2 mol/L��CO2�ı�Ũ����0��8mol/L,����H2�ı�Ũ��Ϊ2��4mol/L�� H2ƽ��Ũ��Ϊ0��6mol/L�������ļ״���ˮ������Ũ�ȶ���0��8mol/L��ƽ��ʱ��Ũ����2��4mol/L,����ʼʱ��Ũ����4mol/L��������ʱ��ѹǿ�ǿ�ʼ��2��4mol/L��4mol/L=0��6������2����-��+�ۡ�4�ã�2CH3OH(l) + 2O2(g) =" 2CO" (g) + 4H2O(l) ��H =-1275��6 kJ/mol��H =-885��6 kJ/mol�����Բ���1molһ����̼��Һ̬ˮ�ų�������Ϊ442��8 KJ����3���״�ȼ�ϵ�صĸ�����ͨ��״��ĵ缫���缫��ӦΪCH3OH+8OH- -6e- = CO32- +6H2O��ÿĦ���ļ״���Ӧת�Ƶ���9Ħ�������ļ״�1��6��ʱ��n(CH3OH)=1��6g��32g/mol=0��05mol,����ת�Ƶ���0��3 NA�������Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������صĸ�����

��ϰ��ϵ�д�
 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
�����Ŀ
 Sx��s�� ��H��akJ/mol
Sx��s�� ��H��akJ/mol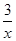 Sx��s�� ��H��bkJ/mol��
Sx��s�� ��H��bkJ/mol��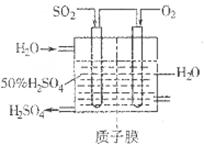
 2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽���� 2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������
2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������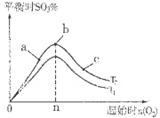
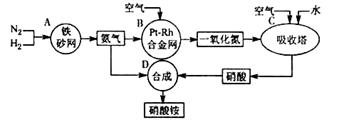

 CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
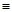 N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������
N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų�______________ kJ������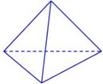
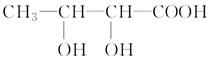
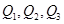 ���߹�ϵ��ȷ����
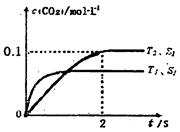
���߹�ϵ��ȷ����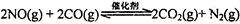 �����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
�����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�