题目内容
我国工业上主要采用以下四种方法降低尾气中的含硫量:
(1)方法1中已知:① CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____;此反应的平衡常数表达式为:_____。

(2)方法2中最后产品中含有少量(NH4)2SO3,为测定(NH4)2SO4的含量,分析员设计以下步骤:
①准确称取13.9 g 样品,溶解;
②向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸;
③加入足量的氯化钡溶液,过滤;
④进行两步实验操作;
⑤称量,得到固体23.3 g,计算。
步骤②的目的是:_____。步骤④两步实验操作的名称分别为: _____、_____。样品中(NH4)2SO4的质量分数:____(保留两位有效数字)。
(3)据研究表明方法3的气配比最适宜为0.75[即煤气(CO、H2的体积分数之和为90%)∶SO2烟气(SO2体积分数不超过15%)流量=30∶40]。用平衡原理解释保持气配比为0.75的目的是:_____。
(4)方法4中用惰性电极电解溶液的装置如图所示。阳极电极反应方程式为_____。
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
(1)方法1中已知:① CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____;此反应的平衡常数表达式为:_____。

(2)方法2中最后产品中含有少量(NH4)2SO3,为测定(NH4)2SO4的含量,分析员设计以下步骤:
①准确称取13.9 g 样品,溶解;
②向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸;
③加入足量的氯化钡溶液,过滤;
④进行两步实验操作;
⑤称量,得到固体23.3 g,计算。
步骤②的目的是:_____。步骤④两步实验操作的名称分别为: _____、_____。样品中(NH4)2SO4的质量分数:____(保留两位有效数字)。
(3)据研究表明方法3的气配比最适宜为0.75[即煤气(CO、H2的体积分数之和为90%)∶SO2烟气(SO2体积分数不超过15%)流量=30∶40]。用平衡原理解释保持气配比为0.75的目的是:_____。
(4)方法4中用惰性电极电解溶液的装置如图所示。阳极电极反应方程式为_____。
(1)2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g) ΔH=-2762.2 kJ/mol;K=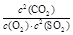 ;
;
(2)使生成的SO2完全逸出,防止SO2被氧化造成误差;洗涤;干燥; 95%;
(3)还原气体过量可以提高SO2的转化率;
(4)SO32-+H2O-2e-=2H++SO42-;
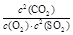 ;
;(2)使生成的SO2完全逸出,防止SO2被氧化造成误差;洗涤;干燥; 95%;
(3)还原气体过量可以提高SO2的转化率;
(4)SO32-+H2O-2e-=2H++SO42-;
试题分析:(1)③+②×2-①×2.整理得2CaCO3(S)+2SO2(g)+O2(g)=2CaSO4(S)+2CO2(g) ΔH=-2762.2 kJ/mol。此反应的平衡常数表达式为K=
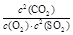 ;(2)向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸目的是使生成的SO2完全逸出,防止SO2被氧化造成误差步骤④两步实验操作分别是洗涤、干燥;n(BaSO4)=n( (NH4)2SO4)=m/M=23.3g÷233g/mol=0.1mol,m((NH4)2SO4)=n·M=0.1mol×132g/mol=13.2g.所以样品中(NH4)2SO4的质量分数(13.2g÷13.9 g) ×100%= 95%.(3)高温下用水煤气将SO2还原为S的方程式为CO(g)+H2(g)+SO2(g)
;(2)向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸目的是使生成的SO2完全逸出,防止SO2被氧化造成误差步骤④两步实验操作分别是洗涤、干燥;n(BaSO4)=n( (NH4)2SO4)=m/M=23.3g÷233g/mol=0.1mol,m((NH4)2SO4)=n·M=0.1mol×132g/mol=13.2g.所以样品中(NH4)2SO4的质量分数(13.2g÷13.9 g) ×100%= 95%.(3)高温下用水煤气将SO2还原为S的方程式为CO(g)+H2(g)+SO2(g) S(s)+ CO2(g)+ H2O(g)。由方程式可知反应时它们的物质的量的比为1:1:1.保持气配比为0.75即还原气体过量,目的是可以提高SO2的转化率,使更多的SO2还原为S单质,从而大大降低尾气中的含硫量。(4)用惰性电极电解Na2SO3溶液,阳极电极反应方程式为SO32-+H2O-2e-=2H++SO42-;阴极的电极反应式为2 HSO3-+2e-= H2↑+2SO32-。
S(s)+ CO2(g)+ H2O(g)。由方程式可知反应时它们的物质的量的比为1:1:1.保持气配比为0.75即还原气体过量,目的是可以提高SO2的转化率,使更多的SO2还原为S单质,从而大大降低尾气中的含硫量。(4)用惰性电极电解Na2SO3溶液,阳极电极反应方程式为SO32-+H2O-2e-=2H++SO42-;阴极的电极反应式为2 HSO3-+2e-= H2↑+2SO32-。
练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 2H2O(l) ΔH="-285.8" kJ/mol
2H2O(l) ΔH="-285.8" kJ/mol N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。 O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol
O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol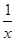 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol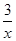 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。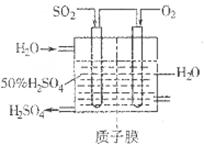
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究: 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。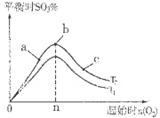
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。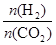 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。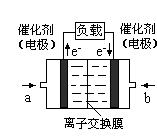

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。