题目内容
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 |
| B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大 始终保持增大 |
A
A项,正反应的活化能可理解为断裂旧化学键吸收的能量,而逆反应的活化能可理解为形成新化学键放出的能量,二者的差值即为反应的热效应,正确;B项,标准状况下,pH=7的溶液不为中性,错误;C项,没指明气体所处的状态为标准状况,错误;D项,当无限稀释时,c(H+)为常数,而c(F-)却不断减小,故 减小,D项错误。
减小,D项错误。
 减小,D项错误。
减小,D项错误。
练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
 2H2O(l) ΔH="-285.8" kJ/mol
2H2O(l) ΔH="-285.8" kJ/mol
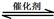 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
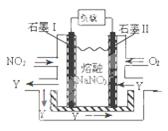
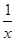 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol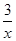 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。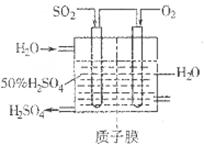
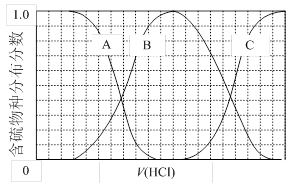
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究: 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。