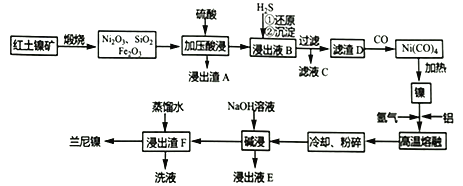
题目内容
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验编号 | 0.01molL﹣1 酸性KMnO4溶液 | 0.1molL﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学程式表示该实验的实验原理:__________________________________________________________________。
(2)实验计时方法是从溶液混合开始记时,至_________________时记时结束。
(3)V1=_____,V2=_____;设计实验Ⅰ、Ⅲ的目的是______________________________。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________。
(5)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①________不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________。
【答案】2KMnO4 + 5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 +10CO2↑ +8H2O 紫红色刚好褪去或混合溶液刚好褪色(或其他合理答案) 1 2 探究温度对反应速率的影响 0.01 mol/(L·min) 温度 MnSO4固体
【解析】
(1)高锰酸钾溶液与草酸反应,反应中C的化合价由+3价升高到+4价,KMnO4中Mn元素化合价由+7价降到+2价,由得失电子守恒配平写出化学方程式。
(2)实验结束的时间计时应为反应恰好完成时间,此时紫红色刚好褪去或混合溶液刚好褪色。
(3)根据控制变量分析设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响,
(4)根据v=![]() 计算用KMnO4溶液表示的平均反应速率。
计算用KMnO4溶液表示的平均反应速率。
(5)①重做Ⅰ号实验,结果温度没有明显变化,则说明温度不是反应速率突然加快的原因;
KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用。
(1)高锰酸钾溶液与草酸反应,反应中C的化合价由+3价升高到+4价,KMnO4中Mn元素化合价由+7价降到+2价,由得失电子守恒配平化学方程式为:2KMnO4 + 5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 +10CO2↑ +8H2O,
故答案为:2KMnO4 + 5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 +10CO2↑ +8H2O。
(2)实验结束的时间计时应为反应恰好完成,此时紫红色刚好褪去或混合溶液刚好褪色,
故答案为:紫红色刚好褪去或混合溶液刚好褪色(或其他合理答案)。
(3)四组实验中草酸溶液的浓度、体积均相等,为了探究高锰酸钾酸性溶液浓度对反应速率的影响,可以加蒸馏水来控制溶液总体积不变,由实验Ⅰ数据可知,总体积为2mL,所以
V1=1mL,V2=2mL;对比实验Ⅰ和实验Ⅲ,其他条件都相同,只是温度不同,所以设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响,
故答案为:1;2;探究温度对反应速率的影响。
(4)实验Ⅲ中,2mL 0.01molL﹣1酸性KMnO4溶液与2mL 0.1molL﹣1H2C2O4溶液反应,草酸过量,用KMnO4溶液表示的平均反应速率为:v(KMnO4)=![]() =0.01 mol/(L·min)。
=0.01 mol/(L·min)。
故答案为:0.01 mol/(L·min)。
(5)①重做Ⅰ号实验,结果温度没有明显变化,则说明温度不是反应速率突然加快的原因;
KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以实验中要加入的少量某种物质是MnSO4固体,
故答案为:温度;MnSO4固体。

 高中必刷题系列答案
高中必刷题系列答案【题目】K2Cr2O7是一种有致癌性的强氧化剂,含Cr2O72—的酸性工业废水必须经过处理才能排放。工业上通常采用Fe电极电解法处理,调节pH值使之以Cr(OH)3沉淀形式除去。某化学兴趣小组在实验室里探究了该处理工艺,具体实验日志如下:
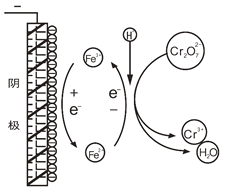
I.原理探查
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:______________________________。
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
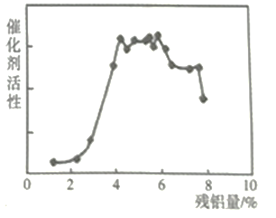
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)

(2)实验结果显示,最佳电解电压应选择_______V。
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为_________mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:__________________________________。
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
实验组 | ① | ② | ③ | ④ | |
加入硫酸铁 /g | 0 | 0 | 5.0 | 0 | |
加入浓硫酸 /mL | 0 | 1.0 | 1.0 | 1.0 | |
电极材料 | 阴极 | 石墨 | 石墨 | 石墨 | 石墨 |
阳极 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-浓度 / mol·L-1 | 初始 | 0.00651 | 0.00651 | 0.00651 | 0.00651 |
结束 | 0.00645 | 0.00568 | 0.00516 | 0.00278 | |
(5)以上实验中,Cr2O72-降解效率最高的是实验组_____(填编号),该实验组阳极电极反应式为:__________________________________。
(6)对比②和③,Cr2O72-降解效率③>②的原因是:__________________________。
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:__________________________________。
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率![]() =______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
=______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
【题目】A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:
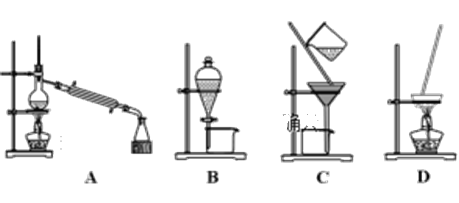
(1)分离植物油和水,选择装置______(填序号),主要使用仪器名称__________;
(2)分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |