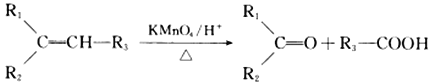题目内容
【题目】K2Cr2O7是一种有致癌性的强氧化剂,含Cr2O72—的酸性工业废水必须经过处理才能排放。工业上通常采用Fe电极电解法处理,调节pH值使之以Cr(OH)3沉淀形式除去。某化学兴趣小组在实验室里探究了该处理工艺,具体实验日志如下:
I.原理探查
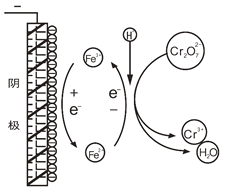
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:______________________________。
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)

(2)实验结果显示,最佳电解电压应选择_______V。
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为_________mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:__________________________________。
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
实验组 | ① | ② | ③ | ④ | |
加入硫酸铁 /g | 0 | 0 | 5.0 | 0 | |
加入浓硫酸 /mL | 0 | 1.0 | 1.0 | 1.0 | |
电极材料 | 阴极 | 石墨 | 石墨 | 石墨 | 石墨 |
阳极 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-浓度 / mol·L-1 | 初始 | 0.00651 | 0.00651 | 0.00651 | 0.00651 |
结束 | 0.00645 | 0.00568 | 0.00516 | 0.00278 | |
(5)以上实验中,Cr2O72-降解效率最高的是实验组_____(填编号),该实验组阳极电极反应式为:__________________________________。
(6)对比②和③,Cr2O72-降解效率③>②的原因是:__________________________。
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:__________________________________。
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率![]() =______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
=______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
【答案】6Fe2+ + Cr2O72- + 14H+= 6Fe3+ + 2 Cr3+ + 7H2O 2(或2 V) 0.001 mol·L—1·min—1 2H2O — 4e— = O2↑ + 4H+ (或4OH— — 4e— = O2↑ + 2H2O) ④ Fe - 2e— = Fe2+ Fe3+在阴极放电产生Fe2+,c(Fe2+)与Cr2O72-反应,提高Cr2O72-降解效率 (或其他合理答案) 14H++ Cr2O72- +6e—=2Cr3++7H2O 13.3%
【解析】
I.(1) Cr2O72—与Fe2+反应生成Fe3+ 和Cr3+,由电子守恒及电荷守恒可得反应的离子方程式。
II. (2)由图可知,电解电压为2V时,Cr2O72-的物质的量最小,所以最佳电解电压应选择2 V。
(3) 根据v=![]() 计算平均反应速率。
计算平均反应速率。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。则为电解水。
(5)通过对比表格中4组实验数据可知,第④实验结束时Cr2O72-浓度最小,说明降解效率最高的是实验组④组,④组阳极材料为活性电极Fe,则电极反应式为:Fe - 2e— = Fe2+。
(6)对比②和③,其他条件都相同,组加入了5.0g的硫酸铁,说明硫酸铁对Cr2O72-降解起了作用,原因是Fe3+在阴极放电产生Fe2+,c(Fe2+)与Cr2O72-反应,提高Cr2O72-降解效率,
(7)由实验组①和②,都用石墨作电极,Cr2O72-直接在阴极放电还原,根据电子守恒写出电极反应式。
(8) 由表格数据求出实验组②中生成产物的电子转移的物质的量,再根据 Q=It=n(e-)F,计算出电路中提供的电子的物质的量,即可求出电流效率。
I.(1) Cr2O72—与Fe2+反应生成Fe3+ 和Cr3+,由电子守恒及电荷守恒可得,反应的离子方程式为:6Fe2+ + Cr2O72- + 14H+= 6Fe3+ + 2 Cr3+ + 7H2O。
故答案为:6Fe2+ + Cr2O72- + 14H+= 6Fe3+ + 2 Cr3+ + 7H2O。
II. (2)由图可知,电解电压为2V时,Cr2O72-的物质的量最小,所以最佳电解电压应选择2 V。
故答案为:2。
(3) 由图可知,电压为6 V时,100mL溶液中含Cr2O72-的物质的量为9.95×10-3mol×![]() =9.95×10-2mol,电解后溶液体积不变为100mL,则用Cr2O72-表示5 min内平均反应速率为
=9.95×10-2mol,电解后溶液体积不变为100mL,则用Cr2O72-表示5 min内平均反应速率为![]() =0.001mol·L—1·min—1。
=0.001mol·L—1·min—1。
故答案为:0.001mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。则为电解水,阳极是水失电子生成氧气,电极反应式为:2H2O — 4e— = O2↑ + 4H+ (或4OH— — 4e— = O2↑ + 2H2O),
故答案为:2H2O — 4e— = O2↑ + 4H+ (或4OH— — 4e— = O2↑ + 2H2O)。
(5)通过对比表格中4组实验数据可知,第④实验结束时Cr2O72-浓度最小,说明降解效率最高的是实验组④组,④组阳极材料为活性电极Fe,则电极反应式为:Fe - 2e— = Fe2+。
故答案为:④;Fe-2e— = Fe2+。
(6)对比②和③,其他条件都相同,组加入了5.0g的硫酸铁,说明硫酸铁对Cr2O72-降解起了作用,原因是Fe3+在阴极放电产生Fe2+,c(Fe2+)与Cr2O72-反应,提高Cr2O72-降解效率,
故答案为:Fe3+在阴极放电产生Fe2+,c(Fe
(7)由实验组①和②,都用石墨作电极,Cr2O72-直接在阴极放电还原,生成Cr3+,电极反应式为:14H++ Cr2O72- +6e—=2Cr3++7H2O。
故答案为:14H++ Cr2O72- +6e—=2Cr3++7H2O。
(8) 由表格数据可知实验组②中,反应的Cr2O72- 的物质的量为:(0.00651mol/L×0.5L-0.00568mol/L×0.5L)=4.15×10-4mol,由电极反应式知转移电子4.15×10-4mol×6=2.49×10-3mol,
根据 Q=It=n(e-)F,电路中提供的电子的物质的量为n(e-)=![]() =0.0187mol,
=0.0187mol,
则实验组②中的电流效率![]() =
=![]() ×100%=13.3%。
×100%=13.3%。
故答案为:13.3%。

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验编号 | 0.01molL﹣1 酸性KMnO4溶液 | 0.1molL﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学程式表示该实验的实验原理:__________________________________________________________________。
(2)实验计时方法是从溶液混合开始记时,至_________________时记时结束。
(3)V1=_____,V2=_____;设计实验Ⅰ、Ⅲ的目的是______________________________。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________。
(5)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①________不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________。